Atom nedir? Atomun yapısı, tarihçesi nedir? Atom kuramları, atomda bulunan elektron, proton ve nötronlar, Atom ağırlığı ve hesaplanması ile ilgili bilgi.

Atom Nedir – Atomun Yapısı
Atom; Maddenin, kimyasal değişimlerle bölünemeyen en küçük parçasıdır. Yunancadaki atomos sözcüğünden türemiştir. Aynı ya da farklı element atomlarından bir ya da birkaçı bir araya gelerek maddenin molekül yapısını oluşturur. Bu nedenle atom, maddenin temel öğesidir. 1803’te İngiliz fizik ve kimyacısı John Dalton‘un ortaya attığı varsayım, üç ana düşünceye dayanıyordu:
- Kimyasal elementler, bilinen kimyasal değişimlerle bölünemeyen ve tüm özelliğini koruyan “atom” adındaki taneciklerden oluşur.
- Aynı kimyasal elementin atomları, kütle, ağırlık ve her yönden özdeştir. Bu yüzden her element, kendi atom ağırlığıyla tanımlanır.
- Öteki tüm kimyasal bileşikler aynı ya da farklı element atomlarının belirli oranlarda bir araya gelmesiyle oluşur.
Bu varsayım, atom fiziğinin temel büyüklüklerinden biri olan atom ağırlığı kavramını da ortaya çıkardı. Bugün tanecik bombardımanlarıyla parçalanabilen ve küresel olduğu düşünülen atomun büyüklüğü konusunda değişik yöntemlerle elde edilen verilerden yarıçapının olduğu saptandı. Ancak her elementin atomu, ona özgü büyüklüktedir. Ortada yarıçapı 10-14 (atomun yarıçapından 10.000 kez daha küçük) olan çekirdek bulunur. Atomun hemen hemen tüm ağırlığı çekirdekte toplanmıştır.
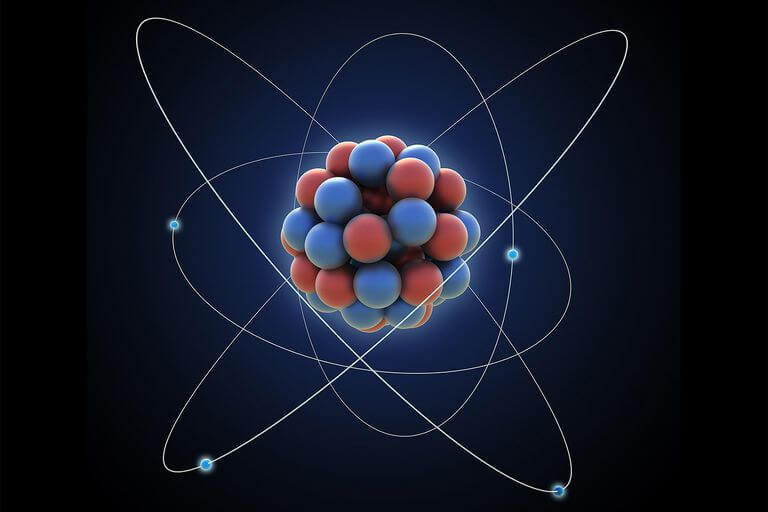
Çekirdeği kuşatan yörüngelerde elektronlar dolaşır. Çok büyük hacimdeki atom, boş bir uzay biçiminde değerlendirilmemelidir. Örneğin çekirdek, yarıçapı 1 cmlik bir bilye oluncaya dek büyültülebilseydi atom, yarıçapı 100 m’lik dev bir küreye dönüşürdü. Tümüyle kuramsal bir kavram olan atomun varlığı, ancak etki ve sonuçlarıyla anlaşılır. Doğada varlığı bilinen element atomlarının sayısı 92’dir. Laboratuvarlarda yapay üretilenlerle birlikte, bu sayı artmaktadır.
Kimyasal Özellikler:
Atom, artı elektrik yüklü bir çekirdekli eksi elektrik yüklü elektronlardan oluşur. Kütlesinin hemen tümü, kütlece yaklaşık eşitlikteki iki tür kararlı tanecikten oluşan çekirdekte toplanmıştır. Artı elektrik yüklü proton ve elektrik yükü olmayan nötrondur. Elektronun kütlesi, protonun kütlesinin 1/1836’sı kadardır. Yükü, protonunkine eşit, fakat eksidir.
Bir atomun kimyasal tepkimesi, elektron sayısıyla (atom numarası) belirlenir. Atomlar arasındaki kimyasal birleşme, dış elektronlarını birbirlerine aktarmaları ya da paylaşmaları demektir. Bohr kuramına göre, atomun çevresindeki elektronların çekirdeğe göre konumları kesin tanımlanmış yörengeler üzerinde hareket eder. Bu yörüngeler, özgül enerji düzeylerine karşılıktır.
Bir foton ya da elektroman ışımanın emilmesi ya da yayınlanması, elektrondaki enerji farkları kuantum kuramınca belirlenmiş yörüngeler arası atlamayla ortaya çıkar. Dalga mekaniğine göre elektron, dalga ve tanecik olarak ikili bir yapı sergilediği için varlığı, matematik yönden bir dalga işleviyle gösterilir. Bohr kuramına göre elektronun tanımlanan kesin yeri, dalga mekaniğinde belirli bir noktada bulunabilme olasılığıyla yer değiştirmiştir. Bu örnekte atom, ortada bulunan bir çekirdek ve bunu saran elektronların belirli bir anda bulunabilecekleri belirli yerlerin olası dağılım biçimiyle gözlenir.
Bir element atomu çekirdeğinde, aynı sayıda proton (p) ve farklı sayıda nötron (n) içerir. Bu türlere, izotop çekirdekleri adı verilir. İzotopların gösterilmesinde elementin kimyasal simgesinin sol üstüne nötron ve proton sayılarının toplamı olan (n+p) kütle yazılır.

Oksijen Atomu
Atom Ağırlığı:
Tek bir atomun kütlesi tartılamayacak kadar küçüktür. Bu olanaksızlık yüzünden, görece atom ağırlıkları kullanılır. Bir kimyasal element atomunun, ağırlığı standart olarak seçilen ve doğada bulunan bir başka elementinkine göredir. Bu kavramı, ilk kez 1803’te İngiliz fizik ve kimyacısı John Dalton ortaya koydu. Görece atom ağırlığı bir oran olduğundan, birimi yoktur. Önceleri hidrojen atomu temel alındı ve atom ağırlığı H:1 varsayıldı. Daha sonra oksijen temel atom olduğundan fiziksel ve kimyasal iki farklı atom ağırlığı düzeni ortaya çıktı.
Oksijenin atom ağırlığı 16.000 ve buna göre hidrojen atomunun ağırlığı 1.0089; karbonun 12.0038, uranyumun 238.14dir. Böyle düzenlenenlere kimyasal atom ağırlığı denir. Kütle spektrometreleriyle bulunan fiziksel atom ağırlığı kimyasal atom ağırlığının 1.00027 ile çarparak hesaplanır. 1960’tan bu yana atom ağırlıklarının belirlenmesinde, kütle spektrometresiyle çalışanlar için, karbon (C-12) atomu standart kabul edilmiştir. Bu düzenlemeye göre atom ağırlıkları, karbonun 12, hidrojenin 1.0078252; uranyumun 238.0486’dır. Oksijen temeline göre düzenlenen kimyasal atom ağırlığı ölçeğinden, karbon temeline dayalı ölçeğe geçiş atom ağırlıklarının sayısal değerinde % 0.0043 oranında azalmaya neden olmuştur.