Atomlarda elektron alışverişi nasıl gerçekleşir? Elektron alanlar, verenler, değerlikler nedir, hakkında bilgi.
Atomlarda Elektron Alışverişi
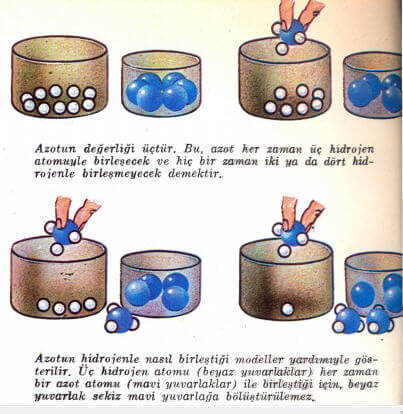
Atomlar bir araya gelerek bileşik moleküllerini yaparken belli oranlarda birleşirler. Örnek olarak, hidrojen klorla bileşik yaparken klor atomu her zaman bir hidrojen atomuyla birleşir, hiç bir zaman iki ya do üç hidrojen atomuyla birleşmez. Bu’ iki atomun birleşmesi sonunda bir hidrojen klorür (gaz hidroklorik asit) oluşur. Hidrojen oksijenle birleşerek su meydana getirirken, her zaman iki hidrojen atomuyla bir oksijen atomu birleşir. Eğer hidrojen azotla birleşerek amonyak yaparsa, her zaman üç hidrojen atomu bir azot atomuyla, yani 3’e 1 oranında birleşir.
Eğer hidrojen karbonla metan (bataklık gazı) yaparsa, dört hidrojen atomu bir karbon atomuyla (yani 4’e 1 oranında) birleşecektir. Böylece değişik elementlerin atomları değişik sayıda hidrojen atomuyla birleşirler. Bir elementin birleştiği hidrojen atomu sayısına, o elementin değerliği denir. Bir klor atomu bir hidrojen atomuyla birleştiğinde, klorun değerliği birdir, oksijenin değerliği ikidir, çünkü bir oksijen atomu iki hidrojen atomuyla birleşir. Azotun değerliği üçtür, çünkü bir azot atomu üç hidrojen atomuyla birleşir. Karbonun değerliği ise dörttür, çünkü bir karbon atomu dört hidrojen atomuyla birleşir. Değerliği bir olan bir atom, değerliği bir olan bir başka atomla birleşebilir. Değerliği iki olan atom ya iki tane bir değerli ya da bir tane iki değerli atomla birleşir.
Bir element atomunun birleşme yeteneği, aşağıda açıklandığı gibi yalnız alıp verdiği elektron sayısına bağlıdır. Bunun için, değerliğin temel birimi bir elektrondur. Hidrojen elementlerin-en basitidir, sadece bir elektronu vardır. Değerliğin «bir element atomuyla birleşen hidrojen sayısına eşit» olmasının bir nedeni de budur.
Bir atomun niçin belli bir değerliğe sahip olduğunu anlamak için, atomların birleşme yollarını incelemek gerekir. Her atomun ortasında pozitif yüklü, oldukça ağır bir çekirdek bulunur. Çekirdeğin etrafında elektron denen negatif yüklü çok küçük tanecikler vardır. Bunlar çekirdek etrafında çok büyük hızla durmadan dönerler ve yörüngeleri bir kabuk meydana getirir. Dış kabukta bulunan elektronlar birleşmelerde etkin olurlar.
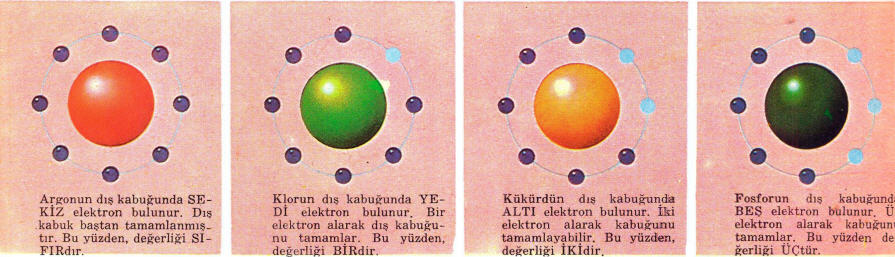
Dış kabukta en çok sekiz elektron bulunur. Eğer dış kabuklarında sekiz elektron (küçük atomlarda bulunan tek kabukta iki elektron) varsa, bu atomlar oldukça kararlıdır ve kolay kolay değişmezler. Soy gazlar adını alan neon, argon, ‘kripton, ksenon hiç kimyasal reaksiyon vermez. Bunların hepsi de dış kabuklarında sekiz elektron bulunan atomlardır. Dış kabukları dolmamış olan atomlar birleşme eğilimi gösterir, bu şekilde dış kabuklarını doldururlar. Atomlar (dış kabuklarına başka atomlardan elektron alarak) başka atomlara elektron vererek, ya da başka atomlarla elektron ortaklığı yaparak doldururlar.
Bazı atomların birden çok değerliği vardır. Bunun bir nedeni, daha içeride bulunan kabuklardaki elektronlardır, bu ileride açıklanacaktır.
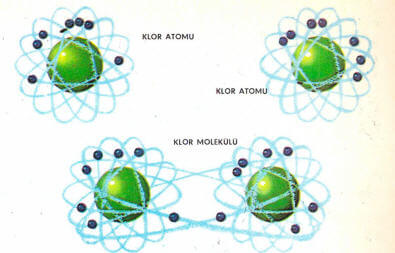
Klor atomunun dış kabuğunda yedi elektron bulunur ve dış kabuğu tamamlamak için bir elektron gerekir. Bir çift klor atomu birer elektronlarını ortaklaşa kullanarak dış kabuklarını tamamlarlar, iki atomun birer elektronundan meydana gelen elektron çifti her iki atomun çevresinde dolaşır ve bu şekilde, bu atomları sıkıca birbirine bağlar. Böyle birleşmeye elektron ortaklığı (kovalans) adı verilir. Atomlar birbiriyle elektron ortaklığı (kovalent) bağıyla bağlanmıştır, denir. Gerçekten klor gazı moleküllerden, yani birbirine bağlanmış atom çiftlerinden yapılmıştır. Halbuki klor gazının birbirinden ayrı atomlardan yapılmış olması beklenirdi.
Başka bir önemli birleşme şekli elektrovalent ya da iyonik bağdır. Sodyum klorür (yemek tuzu) iyonik bağlı maddeler için tanınmış bir örnektir. Bu bileşik klor atomları (her birinin dış kabuğunda yedişer elektron) ile sodyum atomlarından (her birinin dış kabuğunda birer elektron) yapılmıştır. Sodyum tek dış elektronunu vererek sekiz elektronlu dış kabuk yapısı sağlayabilir.
Ama bir elektron kaybeden sodyum atomunda, çekirdeğin pozitif yükü geri kalan elektronların toplam negatif yükünden bir fazladır. Bu yüzden atomun bütünü pozitif yüklü olur. Yüklü sodyum atomuna pozitif iyon denir. Bir klor atomu bir fazla elektron alarak dış kabuğunu tamamlayabilir. Ama gelen fazla elektron atomun bütününü negatif yüklü yapar. Yüklü klor atomuna negatif iyon denir. Sonuç olarak, sodyum’ atomu bir elektronunu klor atomuna vermiştir, diyebiliriz, iyonlar zıt yükler arasındaki çekim kuvveti etkisiyle bir arada tutulur. Sodyum ¡yönüyle klor iyonunun bir molekül yaptığını sanmamalıyız.
Çünkü onlar, klor molekülünün tersine sabit çiftler yapmaz. Dış kabuğu dolu olan bir atom sıfır değerlidir. Dış kabuğunda bir elektron bulunan atom bir ve yine dış kabuğunu doldurmak için bir elektrona ihtiyacı olan atom bir değerlidir. Dış kabuğunda iki elektronu olan atomlarla, dış kabuğunu doldurmak için iki elektrona ihtiyacı olan atomlar iki değerlidir.