Kimyada ayrışma ve yer değiştirme reaksiyonları nelerdir? Ayrışma ve yer değiştirme reaksiyonları, tepkileri, hakkında bilgi.
Ayrışma ve Yer Değiştirme Reaksiyonları
Kimyasal reaksiyonların çoğu dört sınıftan birine girer. Bu sınıfların ilki “birleşme reaksiyonu” adı altında açıklanan ve iki ayrı elementin birleşerek bir bileşik yaptığı reaksiyonların bulunduğu sınıftır. Bir başka reaksiyon da bir bileşiğin daha basit maddelere ayrılmasıdır (ayrışma reaksiyonu).
Bunlardan başka, biraz daha karışık elan iki reaksiyon vardır. Birincisinde bileşiğin içindeki bir iyon diğer bir iyonla yer değiştirir. Eğer gelen yeni iyon bir elementten sağlanıyorsa bu kimyasal değişmeye yer değiştirme reaksiyonu adı verilir. Yeni iyonun diğer bir bileşik tarafından sağlanması “çift yerdeğiştirme reaksiyonu” olarak bilinir. Bu adın takılmasının sebebi, reaksiyon sırasında iki bileşiğin de parçalanıp iyonların yer değiştirmesi sonucu iki yeni bileşik meydana getirmeleridir.

Ayrışma reaksiyonları:
Bu çeşit reaksiyonlarda bir bileşik kendisinden daha basit olan maddelere ayrılır. Bu yeni maddeler bileşik veya element olabilir. Ayrışma reaksiyonunun olması için çoğu ısı (veya başka bir enerji) şart olduğundan, böyle kimyasal değişmeler bazen “ısı (ışık, elektrik vb.) etkisiyle ayrışma” reaksiyonları adıyla da tanınır.
Biraz potasyum klorat kristalleri kuvvetlice ısıtılırsa oksijen gazı çıkar ve geriye potasyum klorür kalır. Laboratuvarda az miktarda oksijen lâzım olduğu zaman çoğu kere bu ayrıştırma reaksiyonu kullanılır. Reaksiyon sırasında potasyum klorata az miktarda manganezdioksit karıştırılırsa ayrışma daha düşük sıcaklıkta olur. Manganez dioksit katalizör olarak etkir.
Nitrogliserinin patlaması olayı ayrışma reaksiyonlarına bir başka örnektir. Daha önceki yazılarımızın birinde gösterildiği gibi, bir nitrogliserin molekülünde çok fazla oksijen vardır. Nitrogliserin patladığı zaman moleküldeki karbon ve hidrojen atomları oksitlendikten sonra bile geriye biraz oksijen kalır. Şayet dışarıdan hiç oksijen verilmemişse, sadece o türlü patlama olayı, ayrışma reaksiyonu sınıfına sokulabilir. Buna karşılık elementlerin çoğunun havadan oksijen almaları gerekir.
Yer değiştirme reaksiyonları:
Aktif olan bazı elementler bir bileşikte daha az aktif olanların yerine geçerler. Bu çeşit değişmelerin olduğu bir reaksiyon “yer değiştirme reaksiyonları” sınıfına girer. Genellikle metaller metallerle, ametaller de ametallerle yer değiştirebilirler. Bir demir parçası, örneğin bir çakı, mavi bakır sülfat eriyiğine batırılırsa, batırılan kısmın rengi hemen kırmızıya döner. Bir kısım demir eriyikteki bakırla yer değiştirmiştir. Yani demir eriyiğe girmiş, bakır eriyen demirin yerine çakıda toplanmıştır.
Şayet demir parçası bir süre daha eriyikte bırakılacak olursa, reaksiyon aynı şekilde devam eder. Bu değişim eriyiğin rengini de değiştirir. Bakır sülfat demir sülfata döner, eriyiğin rengi de mavi iken soluk yeşil olur. Tıpkı bir metalin bir bileşikte bulunan başka bir metalle yer değiştirmesi gibi, ametaller, de birbirleriyle yer değiştirebilirler. Klor (yeşilimsi sarı bir gaz) potasyum iyodür eriyiğinden geçirilirse eriyik kısa zamanda koyu kahverengi bir renk alır. Çünkü klor eriyikteki iyodun yerine geçip eriyiği potasyum klorüre çevirmiştir, iyot, potasyum iyodür eriyiğinde eriyebilmesine rağmen suda erimez. Eğer eriyikte biraz potasyum iyodür kalmışsa iyot da kalır ve siyahımsı gri kristaller halinde çökmez.
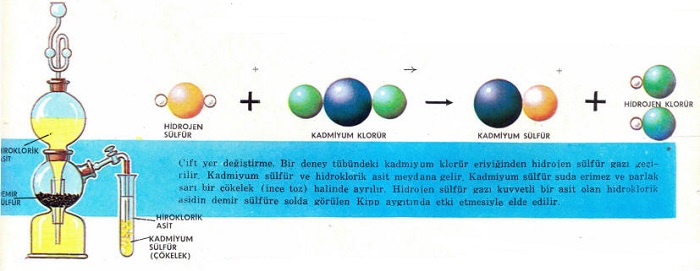
Çift yer değiştirme:
Bu çeşit reaksiyonlara yukarıda bahsedilen diğer reaksiyonlara kıyasla daha sık rastlanır. Çift yerdeğiştirme reaksiyonunda, dört ayrı iyondan (yüklü atom veya grup) oluşmuş, iki bileşik arasında iyonlar yer değiştirir. Böylece iki yeni bileşik ortaya çıkar. Daha sonra da belirtileceği gibi, kimyasal analizlerde çift yerdeğiştirme metodunun kullanılışı küçümsenmeyecek kadar fazladır. Çift yer değiştirme için verilen örnekler arasında en tanınmış olanı asit ve bazın birleşerek tuz ve su meydana getirmeleri olayıdır.
Bu reaksiyonda asidin pozitif hidrojen iyonları bazın negatif hidroksil grubuyla birleşerek su yapar. Diğer taraftan bazın pozitif metal iycnlarıyle asiaın negatif asit kökü birleşir ve tuzu meydana getirirler. Sonuç olarak görülüyor ki ilk iki maddede bulunan iyon çiftleri arasında bir alışveriş olmuştur. Bu reaksiyonun tersi, yani zayıf asitlerin veya zayıf bazların tuzlarının hidrolizi (tuzun su ile birleşmesi) çift yer değiştirmeye başka bir örnektir ve diğer tip hidrolizler de bunun gibidir.
Nitrik asit elde etmenin bir yolu derişik sülfürik asidi potasyum nitrat kristalleriyle ısıtmaktır. Eğer reaksiyon yeter derecede yüksek sıcaklıkta olursa sülfürik Asitteki hidrojen iyonları potasyum nitratın potasyum iyonlarıyla yer değiştirir. Meydana gelen nitrik asit damıtılır ve geriye katı halde potasyum sülfat kalır. Görüldüğü gibi bu reaksiyon başka bir çift yer değiştirme örneğidir. Genellikle reaksiyonun sıcaklık derecesi (özellikle deney laboratuvarında yapılırsa) potasyum sülfat oluşması için yeterli değildir. Onun yerine geriye potasyum bisülfat () kalır.
Potasyum kromat ile gümüş nitrat karıştırıldığı zaman meydana gelen reaksiyon çift yer değiştirmenin başka bir örneğidir. Reaksiyon sonunda gümüş kromat elde edilir. Bu reaksiyonda kromat ve nitrat kökleri «eş değiştirerek» gümüş kromat ve potasyum nitrat maddelerini oluştururlar. Gümüş kromat suda erimediğinden, ince toz şeklinde, kırmızı bir çökelek yaparak ayrılır. Renksiz potasyum nitrat suda eridiğinden eriyik yaparak kalır.
Sonuncu reaksiyon sadece iki tuzun eriyikleri karıştırıldığı zaman oluşan bir çift yer değiştirme örneğidir. Buna karşılık kuvvetli bir asidin kuvvetli bir bazla birleşmesiyle meydana gelen tuzlar eriyikte tamamen iyonlar halinde bulunur. Böyle iki tuzun eriyiği karıştırıldığı zaman eğer bir şey çökmüyorsa, yeni bir maddenin oluştuğunu söylemek çok güçtür. Bu yüzden böyle bir eriyikte iki pozitif ve iki negatif olmak üzere dört ayrı iyon bulunur.