Azot elementinin ve amonyağın özellikleri, Claude yöntemi ile havanın sıvılaştırılması, Azot gazı nasıl saf olarak elde edilir, amonyak nasıl sentezlenir, Azotun bileşikleri ve özellikleri.
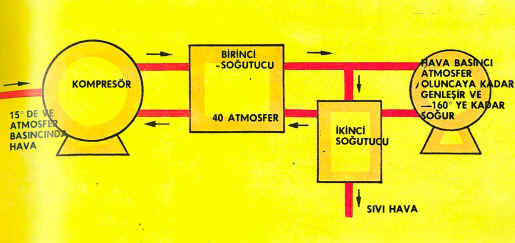
Claude Yöntemi ile havanın sıvılaştırılması
Oksijen içinde büyük bir şiddetle yanan maddelere karşı azot aynı etkiyi göstermez. Azot elementinin oldukça âtıl (tembel) olmasına karşılık azot bileşikleri aktiftir. Azot, magnezyum gibi pek az sayıda elementle doğrudan doğruya birleşir. Eğer magnezyum saf azot içinde ısıtılırsa, magnezyum nitrür oluşur. Gerçekten magnezyum havada yandığı zaman çoğu oksijenle birleşerek magnezyum oksit yaparken az bir kısmı da havanın azotuyle birleşir ve magnezyum nitrür verir. Dünya atmosferinin yaklaşık olarak beşte biri oksijen, beşte dördü azottur. Bu gazlar endüstride sıvı havadan ayrımsal damıtma yoluyla elde edilir. Havada daima su buharı ve karbon dioksit bulunduğu için bunlar giderildikten sonra hava sıvılaştırılır. Bu iş genleşme ve soğutma işlemlerinin yardımıyla sağlanır.
Claude (Klod) yönteminde havanın basıncı adi atmosfer basıncının 40 katına ulaşıncaya kadar sıkıştırılır. Sıkışan hava ısınır. Bu ısı henüz sıvılaşmamış soğuk hava ile alınır, ve böylece sıcaktı —70°C kadar düşer. Soğutulan havanın bir kısmının basıncı bir atmosfere ininceye kadar genleşmesi sağlanır. Bu işlem ısı alır ve sonunda genleştirilen hava —160°C ye kadar soğur. Geriye kalan ve hala basıncı 40 atmosfer olan havanın büyük kısmı, bu genleşen kısım yardımıyle daha soğutulur ve sıvılaşır.
Havadaki gazlar sıvılaştırıldıktan sonra azotla oksijeni birbirinden ayırmak mümkün olur. Zira sıvılaşan bu maddeler değişik sıcaklıklarda yeniden gaz haline dönüşürler (yani kaynarlar). Buna dayanarak sıcaklık kontrol altında tutulur ve oksijenin henüz sıvı olduğu (—183°Cden daha düşük) sıcaklıkta azotun bütünü (—196°Cden daha yüksek sıcaklıkta) gaz haline çevrilir. Sıvı hava bir ayrımsal damıtma kolon aygıtının üstünden akıtılarak kaynaması (buharlaşması) sağlanır. Kolonun (kulenin) alt kısmında sıvı oksijen toplanır. Sıkıştırılmış yüksek basınçlı hava borularla sıvı oksijenden geçirilerek soğutulur. Soğuyan havanın sıcaklığı yine de azotun kaynama sıcaklığından yüksektir. Kolon aygıtında azotun tümü buharlaşır ve aygıtın üst kısmına doğru yükselerek oradan alınır. Sıvı havadan bir miktar oksijen de buharlaşırsa da bu gaz tekrar yoğunlaşma eğilimi gösterir. Buna yardım etmek için sıvı hava kolon aygıtında bulunan delikli raflardan akıtılır. Soğuk sıvı hava aşağı akarken oksijeni de sürükler, sıvılaşan oksijen aşağı iner. Kısa bir süre sonra ayrımsal damıtma kulesinin altında toplanan sıvı hemen hemen saf oksijendir ve aşağı yukarı saf azot yukarı doğru yükselir.
Azot diğer maddelerle birleşmiş olarak tabiatta oldukça yaygındır. Azot tabiattan, başka ayrıca T.N.T ve dinamit gibi patlayıcı maddelerin, bazı ilâçlar, boyalar gibi başka birçok önemli maddelerin bileşiminde bulunur. Proteinler hayvansal hücrelerin ve dokuların büyük kısmını meydana getiren azotlu bileşiklerdir. Proteinler bitki hücrelerinde de bulunur. Et ve yumurta başlıca proteinlerden yapılmıştır. Süt, tohumlar ve bazı meyvelerde büyük oranda protein vardır. Proteinlerin yapıları genel olarak karışıktır. Bunlarda ortalama %16 oranında azot vardır Oksijenle birleşen azot nitröz ve nitrik asit yapabilir. Nitrik asidin tuzlarına nitrat adı verilir. Nitratlara tabiatta da rastlanır. Örneğin Şili güherçilesi adıyla tanınan sodyum nitrat Şili’de büyük kitleler halinde bulunur. Bir başka önemli azot bileşiği amonyak (NH3) adını alan bazdır. Havada bu gaz eserlerine rastlanır, amonyak bileşikleri bitki ve hayvanlarda (örneğin kanda ve idrarda), toprakta ve bazı maden sularında bulunur. Amonyak bazı azotlu organik maddelerin (proteinlerin) bozulmasıyla ortaya çıkar. Amonyak ve amonyum tuzları kok ve havagazı elde edilirken ele geçen gaz suyunda da bulunur. Bu amonyak kaynağı çağımızda artık eski önemini kaybetmiştir. Bugün amonyak büyük ölçüde hidrojen ve hava azotundan sentez (yani bu elementleri birleştirme) yoluyla elde edilir.
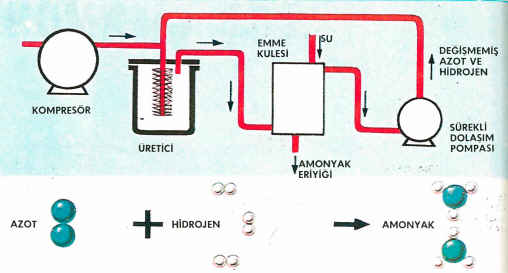
Amonyak Sentezi
Uygun oranda (bir hacim azota karşı üç hacim hidrojen) karıştırılan azot ve hidrojen gazları sıkıştırılır ve reaksiyon odasında ısıtılmış demir kafeslerden (katalizör) geçirilir. Karışımdaki gazların bir kısmı birleşerek bir başka gaz olan amonyağı verir. Oluşan, amonyak gazını azot ve hidrojen karışımından ayırmak gerekir. Amonyak suda eridiği halde azot ve hidrojen erimediği için bu oldukça kolay sağlanır. Reaksiyon odasındaki demir kafes bir kimyasal değişmeye uğramaz. Fakat demir kafes olmadan sentez yapılamaz. Kimyasal değişmeleri kolaylaştıran (hızlandıran) böyle maddelere katalizör adı verilir. Katalizör kimyasal olaylardan değişmemiş olarak çıkar. Amonyak keskin kokulu, renksiz bir gazdır. Havadan hafiftir, baş aşağı çevrilmiş bir kap, amonyakla doldurulabilir. Ne yanıcı, ne de yakıcıdır. Bununla beraber yanan bir çöp, amonyak dolu kabın içine indirilirse alev kısa süre için sarı yeşil renge döner. Bu amonyağın azot ve hidrojeni ayrılmasından ileri gelir.
Amonyak suda çok fazla erir. Bu özellik ilgi çekici «fıskiye deneyi» ile gösterilir. Evlerde temizleyici olarak kullanılan amonyak, amonyağın sudaki eriyiğidir. Bu eriyik baz tepkimesi verir. Kırmızı turnusolu maviye çevirir Asitlerle birleşerek çeşitli amonyum tuzlarını yapar.
Renksiz hidrojen klorür gazı (bunun sudaki eriyiği hidroklorik asit adıyla tanınır) ile dolu bir cam silindir, amonyak gazı doldurulmuş cam silindir üzerine konur ve sonra bunları birbirinden ayıran cam levha çekilirse amonyum klorür dumanları oluşur. Bu da silindirlerin iç yüzeylerinde beyaz toz halinde toplanır. Amonyum sülfat belki en önemli amonyak bileşiğidir. Çünkü bu madde azotlu gübre olarak geniş ölçüde kullanılır. Amonyum sülfat yukarıda adı geçen «gaz suyundan» da elde edilebilir.