Bileşikler nedir? Özellikleri, oluşumu ve farklı örneklerle birlikte anlatılan kapsamlı bir yazı. Su, tuz, karbondioksit ve daha fazlası. Kimyasal yapıları ve kullanım alanları hakkında bilgi edinin.
Bileşik, iki veya daha fazla elementin kimyasal olarak birleşerek oluşturdukları saf maddelere verilen isimdir. Bir bileşiğin oluşması için elementlerin kimyasal tepkimeye girmesi ve atomlarının yeni bağlar oluşturarak moleküller veya kristal yapılar oluşturması gerekir.
Bileşikler, kimyasal formüllerle temsil edilir ve belirli oranlarda elementleri içerir. Örneğin, su molekülü (H2O) bir bileşiktir ve hidrojen (H) ve oksijen (O) elementlerinin kimyasal tepkimeye girerek oluşturdukları birleşimdir. Bileşikler, farklı elementlerin farklı özelliklerini bir araya getirerek yeni özellikler ve bileşikler oluşturabilir.
Bileşikler, doğada bulunan birçok farklı maddeyi oluşturur. Örnek olarak, tuz (sodyum klorür), karbondioksit (CO2), şeker (sakkaroz), demir oksit (Fe2O3) gibi bileşikleri verebiliriz. Bileşikler, kimya alanında önemli bir rol oynar ve birçok endüstriyel, biyolojik ve tıbbi uygulamada kullanılır.
Özellikleri Nelerdir?
Bileşiklerin birkaç temel özelliği vardır:
Sabit Oran: Bileşikler, elementlerin belirli oranlarda birleşmesiyle oluşur. Örneğin, su molekülü (H2O), her zaman iki hidrojen atomu ile bir oksijen atomundan oluşur. Bu oranlar belirlidir ve bileşiklerde değişmez.
Kimyasal Bağlar: Bileşikler, elementlerin atomları arasında kimyasal bağlar oluşturarak stabil molekül veya kristal yapılar oluşturur. Bu bağlar, atomların elektronları paylaşması veya transfer etmesiyle oluşur. Kimyasal bağlar, bileşiklerin özelliklerini belirler.
Farklı Özellikler: Bileşikler, bileşen elementlerin özelliklerini birleştirir ve yeni özelliklere sahip olabilir. Örneğin, hidrojen ve oksijen gaz halindeyken yanıcıdır, ancak su bileşiği olan H2O, yanıcı değildir ve sıvı haldedir. Bileşikler, farklı fiziksel ve kimyasal özelliklere sahip olabilirler, örneğin erime noktası, kaynama noktası, yoğunluk, reaktivite vb.
Kimyasal Tepkimeler: Bileşikler, kimyasal tepkimelere girebilirler. Kimyasal tepkimelerde, bileşikler yeni bileşikler oluşturmak için diğer bileşiklerle reaksiyona girer veya ayrışır. Bu tepkimelerde, bileşiklerin kimyasal bağları kırılır veya yeniden düzenlenir.
Formüllerle Temsil: Bileşikler, kimyasal formüller kullanılarak temsil edilir. Formüller, bileşiğin hangi elementlerden oluştuğunu ve atomlar arasındaki oranları gösterir. Örneğin, suyun kimyasal formülü H2O’dur, bu da iki hidrojen atomunun bir oksijen atomu ile birleştiğini gösterir.
Bu özellikler, bileşiklerin kimyasal yapılarını ve davranışlarını belirler. Bileşiklerin anlaşılması, kimyanın temel prensiplerinden biridir ve birçok uygulama alanında önemli bir rol oynar.
Bileşiklere Örnekler Nelerdir?
Bileşiklere örnekler şunları içerir:
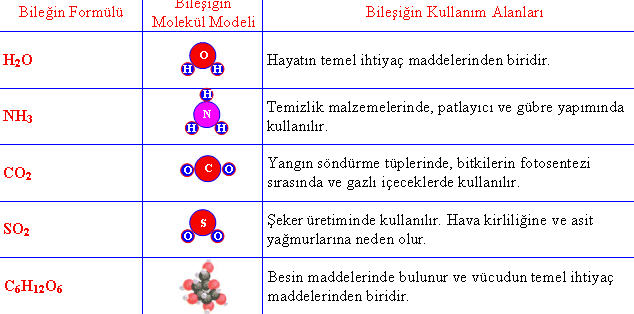
- Su (H2O): Hidrojen ve oksijen elementlerinin birleşmesiyle oluşan bileşik. Hayati öneme sahip olan su, birçok kimyasal ve biyolojik süreçte yer alır.
- Tuz (Sodyum Klorür, NaCl): Sodyum ve klor elementlerinin birleşmesiyle oluşan bir bileşik. Tuz, günlük hayatta yaygın olarak kullanılan bir bileşiktir.
- Karbondioksit (CO2): Karbon ve oksijen elementlerinin birleşmesiyle oluşan bir bileşik. Solunum sürecinde oluşan ve atmosferde bulunan bir gazdır.
- Amonyak (NH3): Azot ve hidrojen elementlerinin birleşmesiyle oluşan bir bileşik. Amonyak, gübrelerde, temizlik ürünlerinde ve kimyasal üretimde kullanılır.
- Şeker (Sakkaroz, C12H22O11): Karbon, hidrojen ve oksijen elementlerinin birleşmesiyle oluşan bir bileşik. Şeker, tatlandırıcı olarak kullanılan ve birçok gıda maddesinde bulunan bir bileşiktir.
- Methan (CH4): Karbon ve hidrojen elementlerinin birleşmesiyle oluşan bir bileşik. Metan, doğal gazın ana bileşenlerinden biridir ve enerji üretimi için kullanılır.
- Demir oksit (Fe2O3): Demir ve oksijen elementlerinin birleşmesiyle oluşan bir bileşik. Demir oksit, pas olarak da bilinir ve yaygın olarak kullanılan bir pigment ve malzemedir.
- Kalsiyum karbonat (CaCO3): Kalsiyum, karbon ve oksijen elementlerinin birleşmesiyle oluşan bir bileşik. Kalker ve kabuklu deniz canlılarının iskeletlerinde bulunan bir bileşiktir.
Bu sadece birkaç örnek olup, doğada ve kimya alanında birçok farklı bileşik bulunmaktadır. Bileşikler, farklı elementlerin birleşerek yeni özelliklere sahip maddeler oluşturmasını sağlar.
Kaynak – 2
Ayrı elemanların birer ve ya daha çok moleküllerinin birleşmesiyle meydana gelen bir cinsli maddelere «bileşikler» denir. Su bir bileşiktir.
Bileşikler, kendilerini teker teker meydana getiren elemanlardan başka özellikler gösterir. Mesela yedi gram kadar demir tozu, dört gram kadar kükürt tozu ile iyice karıştırılıp buna bir büyüteçle bakılırsa demir zerrecikleriyle kükürt zerreciklerinin birbirinden ayrı bulundukları görülür. Bir mıknatıs yaklaştırarak demir taneciklerini kükürt taneciklerinden ayırmak mümkündür. Fakat aynı maddelerin arasına kızgın bir tel sokulursa, bu tanecikler arasında bir tepkime olur siyah bir kütle meydana gelir. İşte bu iki madde artık yeni özellikler kazanmışlardır.
Böylece bütün özelliklerin değişmesiyle meydana gelen bileşiğe “kimyasal bileşik” denir. Bileşiklerdeki elemanlar artık özelliklerini kaybetmişlerdir.
Aynı bileşiği meydana getiren elemanlar arasında ağırlık bakımından değişmez bir oran vardır. Mesela 56 gram demir daima 32 gram kükürtle birleşebilir, Elemanların sayıları sınırlı olduğu halde bu elemanların çeşitli şekillerde birleşmelerinden meydana gelen bileşiklerin sayısı 500.000’i geçmekte, her gün de bunlara yeni keşfedilenler eklenmektedir. Bugün için 40.000 kadar anorganik, 500.000 kadar da organik bileşik bilinmektedir.