İdeal gaz ne demektir? İdeal gazın özellikleri nelerdir? İdeal gaz nasıl olur, var mıdır? İdeal gaz denklemi nedir? İdeal gaz hakkında bilgi.
İDEAL GAZ
Bir gazın basıncı, hacmi ve sıcaklığı birbiriyle bağlantılıdır. İdeal gaz yasası bunların birbiriyle nasıl bağlantılı olduğunu gösterir. Bir gazı ısıtırsanız, genişlemek ister; sıkıştırsanız, daha küçük bir hacme sığıverir ama basıncı artar. İdeal gaz yasası uçakla yolculuk ederken dışarıdaki aşın soğuk havayı düşünüp içi titreyenlerin veya tırmandıkça basınç ile sıcaklığın düşeceğini bilen dağcıların aşina olduğu bir yasadır. Charles Darwin‘in de And Dağları’nın yükseklerinde kamp yaparken bir türlü pişmeyen patatesleri için ideal gaz yasasından dem vurmuşluğu vardır.
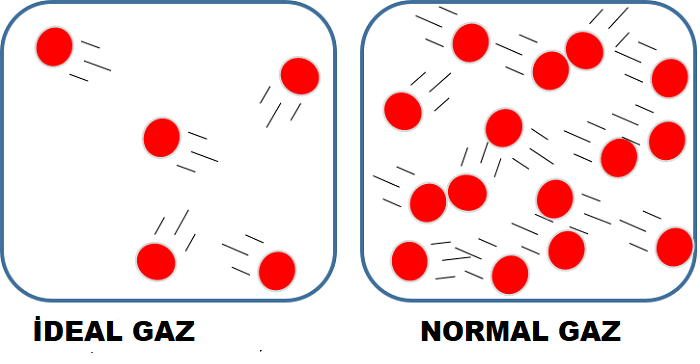
İdeal Gaz; fiziksel davranışı, genel gaz yasasında ifade edilen ideal basınç, hacim ve sıcaklık bağlantısına uyan gazdır. Özel durumlar için geçerli olan Böyle yasası ile Charles yasasının genelleştirilmiş bir biçimi olan genel gaz yasasına göre belirli miktardaki bir gazın hacmi (V) ile basıncının (P) çarpımı, mutlak sıcaklığıyla (T) doğru orantılı olarak değişir ve k deneyle belirlenen bir sabit olmak üzere bu bağıntı PV=kT biçiminde ifade edilir.
Durum (hal) denklemi olarak adlandırılan bu bağıntı maddenin genel davranışını açıklamak için yeterlidir. Gazların kinetik kuramından da çıkarsanabilen genel gaz yasası,
- gazın rastgele hareket eden ve Newton hareket yasalarına uyan milyarlarca molekülden oluştuğu,
- moleküllerin hacminin toplam gaz hacmine göre yok sayılabileceği,
- moleküllerin, çok kısa süren esnek çarpışmaların oluşturduğu etkilerden başka dışarıdan hiçbir kuvvetin etkisi altında olmadığı varsayımlarına dayanır.
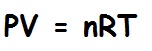
Hiçbir gaz bu özellikleri göstermez; ama oldukça yüksek sıcaklıklarda ve düşük basınçlarda, moleküllerin hızının ve aralarındaki uzaklığın, karşılıklı etkileşimlerin üstesinden gelebilecek düzeyde bulunduğu durumlarda gerçek gazların davranışı genel gaz yasasına yaklaşır. Bir gaz ya da bir gaz karışımının bileşenlerinden biri yoğunlaşma noktasına yakın olduğunda gazın davranışı genel gaz yasasına uymaz.
Gazın miktarını belirleyen gaz sabiti, gazdaki molekül sayısı cinsinden ifade edilirse, genel gaz yasası Avogadro yasasına göre bütün gazlar için uygulanabilecek bir biçimde yazılabilir. Bunun için kütle birimi olarak molekül-gram (gram olarak molekül ağırlığı) kullanılır. Molekül-gram sayısı n olan bir ideal gazın durum denklemi, R evrensel gaz sabiti olmak üzere PV/T=nR biçiminde ifade edilir. Bu gaz sabiti çeşitli gazlar için hemen hemen ideal koşullarda, yüksek sıcaklıklarda ve düşük basınçlarda ölçülmüş ve tüm gazlar için
R=8,314 joule/mol-kelvin
olarak bulunmuştur.
Yorum yapılmamış
çok teşekkür ederim çok yardımcı oldunuz !