Temizlik maddelerinin kimyasal yapıları, kimyasal özellikleri nelerdir? Temizlik maddelerinde hidrofob, hidrofil kısımlar ve özellikleri.
Temizlik Maddelerinin Kimyasal Yapıları
Temizlik maddeleri birçok maddeden oluşan karışımlardır. Bu maddelerden en önemlisi ise birinci derecede temizleme işleminden sorumlu olan aktif maddelerdir (aktif molekül).

Temizlik maddelerinin içindeki aktif maddelerin kimyasal yapılarını karşılaştırdığımızda birbirine benzedikleri gözlenir. Öncelikle sabun ve deterjanların organik maddelerde de aynı olan yapısal özelliklerini genel olarak incelemek gereklidir. Bu yapısal özellik suyu seven(hidrofil) ve suyu sevmeyen(hidrofob) kısımlardan oluşmalarıdır.
HİDROFİL VE HİDROFOB GRUPLAR
Organik bileşiklerden apolar olanlar yani hidrokarbonlar suda çözünmezler. Ancak fonksiyonlu grup içeren bir çok organik bileşik suda çözünür. Bunun nedeni bu organik bileşiklerin polar karakterli olmasıdır.
Bir bileşiğin suda çözünmesini sağlayan en önemli faktör, o bileşiğin su ile fiziksel bir çekim oluşturabilecek bir grup içermesidir.
işte hidrofil ve hidrofob kavramları bu durumu açıklayan kavramlardır.
1. Hidrofil
Bir molekülde, fiziksel çekim kuvvetleri ile bağlar kurarak suya bağlanabilme özelliğine sahip olan uç ya da kısımdır. Yunanca hidros (su) ve filia (arkadaşlık) sözcüklerinden türetilmiştir. Bu özelliğe sahip moleküller su ve diğer polar çözücülerde çözünebilir.
– OH, – COOH, -NH2 , -SO3H gibi gruplar hidrofil gruplardır. Bu grupları içeren moleküller su içerisinde ve diğer polar çözücülerde çözünürler.
2. Hidrofob
Yunanca hidros (“su”) ve fobos (“korku”) sözcüklerinden türetilmiş, bir molekülün sudan kaçınma özelliğidir.
Hidrofob moleküller genelde apolardır ve polar çözücülerde genellikle çözünmezler.
Su ile karıştırılan hidrofob moleküller genelde kümelenirler. Bu nedenle ıslanabilirlikleri çok az veya yoktur.
Hidrofob moleküllerin örnekleri arasında hidrokarbonlar ve yağlar sayılabilir.
İçerisinde yalnızca C ve H atomu içeren karbon zincirleri hidrofob kısımlara örnek olarak verilebilir.
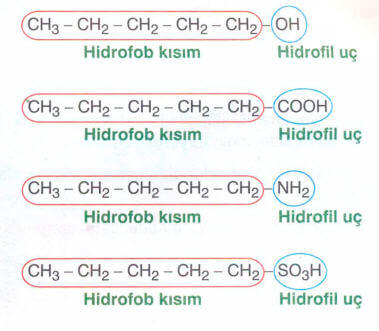
***Hidrofil grup içeren organik bileşikler polardır. Bu nedenle suda ve diğer polar çözücülerde çözünürler.
***Yalnızca hidrofob grup içeren organik bileşikler ise suda ve diğer polar çözücülerde çözünmezler.
Örneğin, bir sabun ve bir deterjan aktif maddesinin moleküllerinin karşılaştırılması aşağıda verilmiştir.
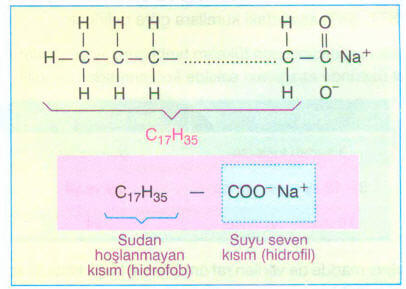
“Sodyum stearat” Bir sabunun aktif molekülü

“Sodyum dodesil benzen sülfonat” Bir deterjanın aktif molekülü
Sabunların ve deterjanların yapıları incelendiğinde aktif moleküllerinin,
***Çok sayıda atom içeren uzun moleküller oldukları
***Yapılarında çok sayıda C (karbon) ve H (hidrojen) atomunun bulunduğu
***Bir uçlarının suyu seven (hidrofil) diğer uçlarının ise sudan hoşlanmayan (hidrofob) yapıda oldukları görülür.
Not: Uzun yıllar kullanıldıktan sonra, çevre kirliliğine sebep olduğu anlaşılan sodyum dodesil benzen sülfonatın birçok gelişmiş ülkede deterjan aktif maddesi olarak kullanımı yasaklanmıştır.
***Hidrofil kısımların daha küçük, kısa ve polar (kutuplu) yapıda, hidrofob kısımlarının ise uzun bir zincir şeklinde ve apolar (kutupsuz) yapıda oldukları kolaylıkla anlaşılabilir.