Titrasyon ve ph değişimi takibi nasıl yapılır? Mol sayısı ve nötralleşme, titrasyon ve indikatör kullanımı hakkında bilgi.
Titrasyon ve Uygulamaları
Çözeltilerin pH değerlerini belirlemek için farklı pH değerlerinde farklı renk alabilen boyar maddeler kullanılır. Bu tür maddelere indikatör (belirteç) adı verildiğini bir önceki bölümde ifade etmiştik. indikatörler genellikle organik bileşiklerdir.

Not Nötrleşme tepkimeleri sırasında çözeltinin pH değeri değişir. Bir asit çözeltisine, baz çözeltisi eklenirse pH değeri artar. Bir baz çözeltisine, asit çözeltisi eklenirse, pH değeri azalır.
1. Mol Sayısı ve Nötralleşme
Asitler ve bazlar suda az ya çok iyonlaşabilen maddelerdir. Bu nedenle çözündükleri miktar kadar suda veya
iyonu oluştururlar.
***Bir kuvvetli asidin oluşturduğu iyonu ile kuvvetli bazın oluşturduğu
iyonu nötrleşme olayında suyu (H20) oluşturur.
***Birbiri ile karıştırılan asit ve bazın içerdikleri iyonunun mol sayısı ile
iyonunun mol sayısı eşit olduğunda hem asit hem de baz tükenir. Bu noktada indikatör renk değiştirdiğinden dönüm noktası adı verilir.
***Kuvvetli asit ve kuvvetli baz çözeltilerinin karıştırılması sonucunda dönüm noktasına ulaşıldığında pH değeri 7 olur.
Eşit mol sayısında ve
iyonu içeren kuvvetli asit ve bazlar karıştırıldığında yani dönüm noktasında bulunduklarında,
Örneğin birer litresinde eşit mol sayısında bir değerli kuvvetli asit ve bir değerli kuvvetli baz içeren çözeltiler karıştırılırsa gerçekleşen nötralleşme tepkimesi sonucunda oluşan son çözelti nötrdür ve pH = 7 olur.
Kural
***Eğer kuvvetli asidin iyonu mol sayısı, kuvvetli bazın
iyonu mol sayısından fazlaysa,
ve
iyonları arasında tam nötrleşme olmaz. Bir miktar
iyonu artar. Böylece ortamda artan miktar kadar asitten gelen H+ iyonu bulunur. Bu durumda çözelti asidiktir ve pH < 7 dir.
***Eğer kuvvetli bazın
iyonu mol sayısı, kuvvetli asidin
iyonu mol sayısından fazlaysa,
ve
iyonları arasında tam nötrleşme olmaz. Bir miktar
iyonu artar. Böylece ortamda artan miktar kadar bazdan gelen
iyonu bulunur. Bu durumda çözelti baziktir ve pH > 7 dir.
***1 mol HCI asidi 1 mol iyonu ve 1 mol NaOH bazı 1 mol
iyonu içerir.
Buna göre 1 mol HCI ve 1 mol NaOH tepkimeye girerse nötralleşme tam olur.
***1 mol asidi 1 mol
iyonu ve 1 mol
bazı 2 mol
iyonu içerir.
Buna göre nötralleşmenin tam olması için 2 mol asidi ile 1 mol
bazı tepkimeye girmelidir.
***1 mol asidi 2 mol
iyonu ve 1 mol KOH bazı 1 mol
iyonu içerir.
Buna göre nötralleşmenin tam olması için 1 mol asidi ile 2 mol KOH bazı tepkimeye girmelidir.
2. Titrasyon ve İndikatör Kullanımı
Kuvvetli asit ve bazların karıştırılmasında dönüm noktasına ulaşılıp ulaşılmadığı uygun indikatör kullanılarak belirlenebilir. Kuvvetli asitlerin dönüm noktasını belirlemek İçin pH = 7 nin hemen altında veya hemen üstünde renk değiştiren indikatörler kullanılabilir.
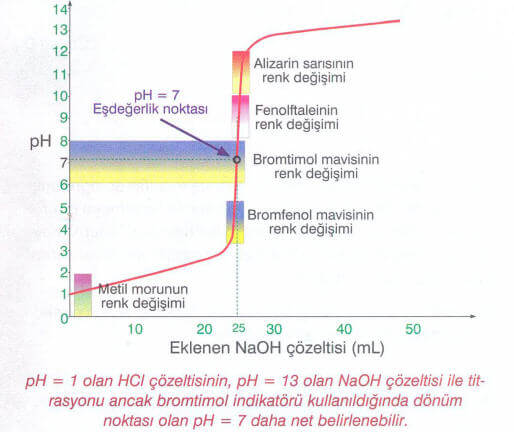
Örneğin, bromtimol mavisi pH < 6,0 değerlerinde sarı renkli, pH > 7,6 değerlerinde ise mavi renklidir. 6,0 < pH < 7,6 aralığında ise bromtimol mavisi geçiş rengi olan yeşil renklidir.
Bir asit ya da baz çözeltisinin dönüm noktasını belirlemek için uygun bir indikatör kullanılarak bir asit çözeltisine yavaş yavaş baz veya bir baz çözeltisine yavaş yavaş asit eklenmesi işlemine titrasyon denir. Titrasyon genellikle çözeltilerin derişimlerini belirlemek için yapılır. Derişimi bilinmeyen çözelti derişimi bilinen bir referans çözelti ile titre edilerek bilinmeyen derişim bulunur.
Örneğin
***pH değeri 1 olan HCI çözeltisine bromtimol mavisi atıldığında pH < 6,0 olduğundan renk sarı olur.
***Bu aside büret yardımıyla pH değeri 13 olan NaOH kuvvetli baz çözeltisinden yavaş yavaş eklendiğinde nötrleşme olacağından iyonu derişimi azalır ve pH yavaş yavaş yükselir. pH değeri 6,0 yı geçtiğinde çözelti rengi yeşil olur. NaOH eklenmeye devam edilir.
***Öyle bir an gelir ki bir damla NaOH çözeltisi eklendiğinde dönüm noktası (pH = 7) geçilir ve çözeltinin pH değeri 7,6 ya ulaşır ve geçer.
***Bu noktada indikatörün rengi maviye dönüşür.
***Bu anda NaOH eklenmesi bırakılır. Çünkü dönüm noktasına ulaşılmıştır.
Titrasyonlarda eklenen çözelti hacmi ile karışımın pH değerindeki değişimi gösteren grafikler çizilir. Bu tür grafiklere pH grafikleri adı verilir. Yukarıdaki HCI çözeltisinde bromtimol mavisi indikatörlüğünde NaOH çözeltisi eklenerek yapılan titrasyonun pH grafiği aşağıdaki gibidir.