Lityum elementinin özellikleri, atom numarası, bileşikleri, tarihçesi, periyodik cetveldeki yeri, kullanım alanları, Lityum elementi ile ilgili bilgi.
Lityum
Lityum 1A grubu elementlerindendir. Bu gruptaki elementlere alkali metaller denir. Lityumun sıvı haldeki yoğunluğu suyun sadece yarısı kadardır. Katı halde ise en hafif metaldir. Lityumun yüzeyinden kesilince yüzey gümüş renktedir, ancak bir dakika içinde havayla temasıyla beraber gri bir yüzeye dönüşür. Oksijenler reaksiyona girmiştir ve lityum oksit (Li2O) oluşturmuştur. Lityum elektron verme ve artı yüklenme eğilimindedir.
Sembolü: Li
Atom Numarası: 3
Atom Ağırlığı: 6.941(2) g/mol g/mol
Elektron Sayısı: 3
Elemet serisi: Alkali Metal
Periyodik Tablodaki Yeri: 1A
Maddenin Hali: Katı
Görünümü: Gümüşümsü gri, beyaz
Lityum kolayca oksitlenir. Bileşimleri kırmızı bir alevle yanar, soğuk suda çözünür. Arı durumdayken öteki alkali metallere oranla daha az tepkinir. Çözelti halinde güçlü bir indirgendir. Şiddetle yandığında göz kamaştırıcı beyaz renkli bir ışık verir.
Kullanım Alanları:
Başlıca kullanım alanı pillerdir. Lityum, lityum pil anot olarak kullanılmaktadır. Alkalin piller gibi, çinko pillere göre daha fazla güce sahiptir. Ayrıca ısı transferi alaşımlarında kullanılır. Lityum organolityum bileşikler yapmak için kullanılır. Bunlar çok güçlü bazlar için kullanılır.
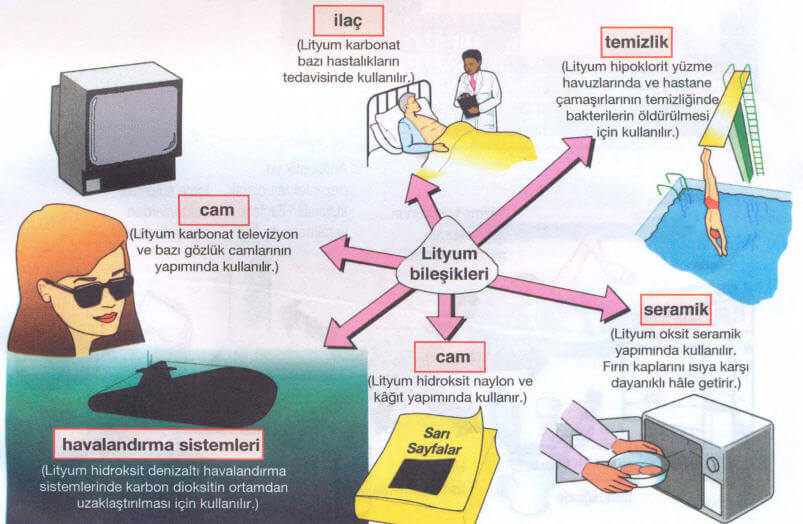
Lityumlu bileşikler farmakolojik olarak sakinleştiricilerde kullanılır. Lityum niobate radyo vericileri, cep telefonlarında kullanılır. Bazı lityum bileşikleri de seramikte kullanılır. Lityum klorür, suyu abzorbe edebilir. Bazı lityum bileşikleri, sabun ve yağ yapmak için kullanılır.
İkinci Dünya Savaşından sonra lityum metalinin ve bileşiklerinin üretimi hızla arttı. Metalürjide bakırı ve bakır alaşımlarını zehirli gazlardan arıtmada kullanılır. Temelini kurşun ve kalsiyum oluşturduğu bazı alaşımları sertleştirir. Bunların yanı sıra özgül ısısı en yüksek element olduğu için ısı aktarımında önemli yere sahiptir. Bileşiklerinden lityum klorür ve lityum bromür en güçlü nemçeker maddelerdir. Bu özelliği ile endüstride kurutma işlemlerinde ve nem çekici aygıtlarda kullanılır.
Lityumun Elde Edilmesi:
Öncelikle 1100 °C’ de a formu ısıtılarak daha yumuşak b formuna dönüştürülür. b formu sıcak sülfürik asit ile reaksiyona sokularak Li2SO4L2So4H5rt5 elde edilir. Elde edilen bu çökelek çözeltiden ayrılarak Na3CO3 ile yıkanır. Böylece suda çözünmeyen LiCO3 elde edilir.
Li2SO3 + Na2CO3 → Na2SO4 + Li2CO3 (katı)
Elde edilen Li2CO3 çökeleği HCl ile reaksiyona sokularak LiCl elde edilir.
Li2CO3 + 2 HCl → 2 LiCl + CO2 + H2O
LiCl erime noktası 600 °C den fazla olduğu için elektroliz ile saflaştırılması zor olduğundan LiCl (55%) ve KCl (45%) karışımı kullanılarak erime noktası 430 °C’ye düşürülür. Bu karışımın elektrolizi ile Li saf olarak elde edilir.
- Katot: Li+ (s) + e- → Li (s)
- Anot: Cl- (s) → ½ Cl2 (g) + e-
Tarihçesi Keşfi
Lityum, 1817 yılında Johann August Arfvedson tarafından mineral petalitte keşfedildi. İlk olarak William Thomas Brande ve Sir Humphrey Davy tarafından lityum oksidin (
) elektrolizi yoluyla izole edildi. Bugün, lityum klorürün (LiCl) elektrolizi ile daha fazla miktarda metal elde edilmektedir. Lityum doğada serbest bulunmaz ve yer kabuğunun sadece% 0.0007’sini oluşturur.

47 yorum
bence çok yararlı bi biligi tavsiye ederim (KOÇlarrrrrrrrrrr)
ÇOK İYİ OLMUŞ YANİ BİR PERFORMANS ÖDEVİ ÇIKTI BİZE
süperrrrrrrrrrrrrrr olmuşşşşşşşşşşşş
süper performans ödevimi bunun sayesinde yaptım
süper performans ödevimi bunun sayesinde yaptım.
HARİKAYDİ
daha çok bilgi olmalı bence
Harika teşekürler çok işe yaradı. Thank you
Lityum atomunda kac proton, kac notron, kac elektron oldugunu yazarmisiniz. Bide klor ve lityum atomu birlesirse kovalent bag ile 2 elektronu paylasirlar mi yoksa iyonik bag ile 2 elektronu lityum klora mi verirrrrrrr. Acil cevap lutfen…
çok güzel süüüüüüüperrrr olmuş performansıma işe yaradı
ya her 20 element için ayrı ayrı ayrı yazıyorum herbiri 2 sayfa sürüyor birde resim 45 sayfa gidiyor
Super Olmus Keşke İlk 20 Elementin Bılgileri Olsa Bızım Performans Oyle Vermıs Hoca İlk 20 Element Hem Ozellıkler Hemde Kullanım Alanları
Periyodik tablodan tüm elementlerin özelliklerini ve kullanım alanlarını bulabilirsiniz. İşte linki http://www.nkfu.com/periyodik-cetvel/periyodik-cetvel.html
bnde performans ödevimi yapıyommmm
bende proje ödevimde yararlandım ama daha fazla olsaydı bilgiler daha iyi olurdu bence
çooook güzel olmuş performansdan 100 aldım çoook teşekkür ederim
tşkür
Allah razi olsun çok isime yaradi (y)
saol performan ödevi buldum 😀
sağolunn çokk işime yaradı!!!
çok çok teşekkürler…
saolun walla sizde olmasanız
çok teşekür ederim yardımcı olduğunuz için
çok sağolun
çok işime yaradı 😀
harika mutiiiiiiiiiiiiiiş
ÇOK LAZIMDI SAOLun 😀 😀 😀 : d
çooooooooooookk teşekkürler işime çooooooooooookk yaradı
işimeeeeeeeeeeeeeeeeeeeeeee çoooooooooooooooooooook yaradıı teşekkür ederizz
çok iyi performans ödevi
süper performans odevinibundan yaptım
cokk ise yaradi saaolun 🙂 🙂 B-)
Cok tesekur ederim
Çok İşime Yaradı Yazanın Eline Koluna Sağlık 😀 😀 😀
oha abi yaa çok iyiyimiş bu etüt ödevimdi yaptım hoca çok beğendi bee bi diha hep burdan yapıcam söz :):)
çok güzel bi site çok işime yaradı bee teşekkür ediyorum bunu yazanım ellerine sağlık 🙂
çokkkk teşekürleeeeerrrrr 🙂 <3
cok güzel bee abi bidahiki ödevlerimi burdan yapcam.
Çok İyi Bir Site Çok Sevdim Elinize sağlık ödevlerimi yaptım sınavlarımı calıştım
Bu sitede çok güzel tsk
aynen öyle çok işime yaradı
Çok ama çok teşekkürler
Çok ama çok teşekürler
çook güzel site çok yardımcı oldu teşekkür ediyorummmm 🙂
çok güzel bi site saolun canısı
Çok güzel bir yer . Proje ödevlerimi hep buradan yapıyprum .
Allah Bu Siteyi Kurandan Razı Olsun Bu Site Sayesinde Kimya Dersinden Geçtim Çok Teşekkür Ederim… 🙂 <3