Atomların (ekivalent) eşdeğer ağırlığı nedir? Eşdeğer ağırlık ne anlama gelir ve nasıl hesaplanır? Eşdeğer ağırlık hakkında bilgi.
Eşdeğer Ağırlık Nedir? Nasıl Hesaplanır?
Kabul etmek gerekir ki molekül ağırlığı ve ekivalent ağırlık kimyacılar için çok önemlidir. Çünkü maddelerin ziyan olmadan reaksiyona girmeleri için ne miktar karıştırılması gerektiğini bilmelerine imkân verir. Aynı zamanda ele geçen ürünün ağırlığının hesaplanmasını sağlar.
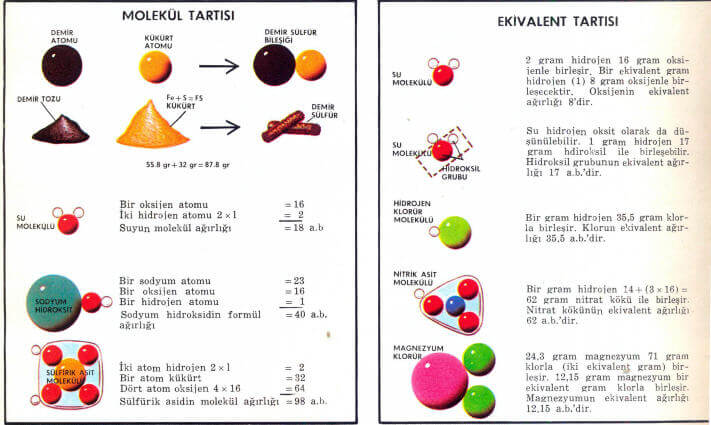
Moleküllerden yapılmış bir bileşiğin molekül ağırlığı, onun bir molekülünün ağırlığıdır. En büyük atomların ve moleküllerin bile ağırlığı o kadar küçüktür ki bunu gram veya miligram cinsinden ölçmek mümkün değildir. Örneğin diğer element atomlarıyla karşılaştırıldığı zaman çok ağır olduğu görülen kurşun atomu aşağı-yukarı 0,00000000000000000000034 gram ağırlığındadır. Öyle ise ayrı bir ölçü sistemi kullanmak gerekir. Karbon atomunun ağırlığı 12, ağırlık birimi (a.b.) kabul edilir ve atom ağırlığı 12 a.b. olur. Diğer element atomlarının ağırlığı bununla mukayese edilerek söylenir. Örneğin, bir atom karbondan iki defa ağırsa, atom ağırlığı 24 ağırlık birimi olur (magnezyumda olduğu gibi). Moleküller kimyasal bağlarla bağlanmış atomlardan yapılmıştır. Her atomun bir ağırlığı vardır, bununu sonucu olarak molekülün ağırlığı (molekül ağırlığı) molekülü meydana getiren atomların ağırlıkları toplamıdır. Bileşik moleküllerden yapılmamışsa, atomların atom ağırlıkları toplamı formül ağırlığını verir.
Atom ağırlıkları listesini kullanarak birbiri ile reaksiyona girecek maddelerin ağırlıklarını ve ele geçen ürünün ağırlığını bulmak çok kolaydır Demir tozu kükürtle beraber kuvvetle ısıtılırsa demir sülfür bileşiği oluşur. Bileşiğin her yerinde bir demir atomu ile bir kükürt atomu birleşerek demir sülfür bileşiğini yapmıştır. Kükürtün atom ağırlığı 32 a.b. demirinki 55,8 a.b.’dir. Demir sülfür bileşiminde bir demir ve bir kükürt atomu bulunduğuna göre, bunun ağırlığı 55,8 + 32 = 87,8 a.b. olur. Demir sülfür bileşiğinin formül ağırlığı 87,8 a.b.’dir. Eğer 55,8 gram demir, 32 gram kükürtle karıştırılırsa reaksiyon sonunda 87,8 gram demir sülfür oluşur, geriye demir veya kükürt kalmaz.
Sud kostik (sodyum hidroksit) eriyiği hidroklorik asitle nötürleştirildiği zaman tuz ve su oluşur. Eğer çok asit kullanılırsa eriyik asidik olur. Tersine az kullanılırsa eriyik bazik olur. Tam nötürleşme olması için uygun ağırlıkta asit ve bazı karıştırmak gerekir. Sodyum hidroksidin formül ağırlığı, bir atom sodyum, bir atom oksijen ve bir atom hidrojenin ağırlıkları toplamıdır (23 + 16+1 =40). Hidroklorik asidin molekül ağırlığı bir hidrojen ve bir klor atomunun ağırlıkları toplamıdır (1 +35,5 = 36,5). 36,5 gram saf hidroklorik asit (hidrojen klorür) tam olarak 40 garm sodyum hidroksidi nötürleştirir.

Potasyum iyodür renksiz bir eriyiktir, eğer bu eriyikten klor gazı geçirilirse renk siyaha döner. Çünkü klor iyodun yerine geçer, serbest halde ayrılan iyot siyah renkte görülür. 35,5 gr. klor (klorun atom ağırlığı 35,5 a.b.) 127 gr. iyodun (iyodun atom ağırlığı 127 a.b.) yerine geçer. 35,5 gr. klor 127 gr. iyotla eşdeğerdir (ekivalenttir). 35,5 a.b. klorun, 127 a.b. iyodun eşdeğer (ekivalent) ağırlığıdır, keza hidrojenin atom ağırlığı da ekivalent ağırlığına eşittir. 36,5 gr. hidroklorik asit içinde birleşmiş olarak 35,5 gr. klor ve 1 gr hidrojen vardır. Buna göre bir ekivalent gram klor bir ekivalent gram hidrojenle birleşmiştir. 63 gr. nitrik asitte bir ekivalent (eşdeğer) gram hidrojen 62 gr. nitrat kökü ile birleşmiştir. Nitrat kökünün (grup) ekivalent ağırlığı 62 a.b.’dir.
Yukarıda sözü geçen maddelerin atom ağırlıkları ile ekivalent (eşdeğer) ağırlıkları aynıdır, çünkü adı geçen elementlerin hepsinin (nitrat kökünün de) değeri birdir.
İki değerli bir elementin ekivalent ağırlığı atom ağırlığının yarısı kadardır. Bir parça magnezyum metali (değeri iki) hidroklorik asit içine atılırsa, hışırdayarak ve köpürerek hidrojen gaz> çıkar ve asit eriyiği magnezyum klorür eriyiğine dönüşür. Her magnezyum klorür bileşiğinde bir magnezyum, iki klor atomu bulunur. Bir atom gram yani atom ağırlığı kadar gram magnezyum iki ekivalent gram klorla birleşmiştir, öyle ise magnezyumun ekivalent ağırlığı atom ağırlığının yarısı olmalıdır (bir ekivalent gram klorla birleşen miktar). Yine bu reaksiyonda bir atom gram magnezyum iki ekivalent gram hidrojen çıkarır. Bunlardan anlaşıldığı gibi ekivalent ağırlığı = atom ağırlığı/2 dir. Bileşiklerinde iki değerli olan çinko metali seyreltik hidroklorik asitle aynı şekilde reaksiyon vererek çinko klorür meydana gelir. Yukarıdaki düşünce tarzı buraya da aynen uygulanabilir.
Demir, bileşiklerinde üç değerli olabilir. Demir (3) tuzu eriyiği içine sodyum hidroksit eriyiği ilâve edilirse, kahve rengi peltemsi demir (3) hidroksit çökeleği oluşur. Reaksiyonda bir demir (3) iyonu üç sodyum atomu ile yer değiştirmiştir. Bir tane üç değerli demir atomu üç tane sodyum atomuna eşdeğerdir (ekivalenttir). Bu demirin eşdeğer ağırlığı
Eşdeğer Ağırlık = Atom ağırlığı / Değerlik olur.
Pek çok kimyasal madde, laboratuvarda, çeşitli derişiklik derecesinde (kuvvette) kullanılır. Bu derişiklik
genellikle bir litredeki ekivalent gram (gram olarak) sayısı olarak ifade edilir.
Eğer bir litre eriyikte bir ekivalent gram madde erimiş olarak bulunursa bu eriyiğe 1 normal veya kısaca normal eriyik denir. Eğer iki ekivalent gram madde erimiş ise 2 normal v.b. söylenir. Bir ekivalent gram hidrojen 1, bir ekivalent gram klor 35,5 tur. Normal hidroklorik asit eriyiği, bir litrede 36,5 gram hidrojen klorür ihtiva eden eriyiktir. Bir elementin veya bir grubun ekivalent (eşdeğer) ağırlığı, bir gram hidrojen veya 35,5 gram klorla birleşen veya yer değiştiren maddenin gram miktarıdır.
