Amino asitler ile ilgili genel bilgiler. Amino asitler nelerdir ne gibi özellikleri vardır, nasıl elde edilirler, genel formülleri ve örnek amino asitler hakkında bilgi.
Amino Asitler, proteinlerin yapı taşları olan amino asitler hem asit özellikteki karboksil (-COOH) ve hem de baz özellikteki amino (-NH2) grubunu taşıyan kimyasal bileşiklerdir. Amino grubunun bulunduğu yer alfa, beta, alfa olarak belirtilir. Yaşam açısından önemli olan alfa-amino asitlerdir. Fakat buna karşılık bazı peptidler-de beta-amino asitler de bulunmuştur. Örneğin beta-alanin gibi. Bunlarda amino grubu karboksil grubuna komşu olan karbon atomu üzerinde bulunur. Alfa-amino asitlerin genel formülü:
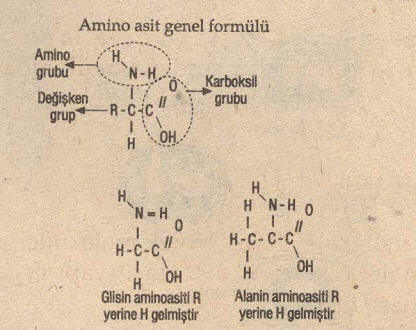
Amino Asit Genel Formülü
biçimindedir. Burada R grubu, hidrojen ve amino grubu karboksilden sonra gelen karbon atomuna bağlıdır. Amino asitlerin ortak olan fiziksel ve kimyasal özellikleri karboksil ve amino gruplarının varlığına ve bunların uzaydaki düzeyine bağlıdır. Amino asitlerin bireysel özellikleri ise R gruplarınca belirlenir. Amino asitlerin tarihi 1806’dan asparagas (kuşkonmaz) suyundan asparagin adlı amino asidin elde edilişiyle başlar 1820’de yüksek molekül ağırlıklı bir protein olan jelatinin seyreltik sülfat asidiyle hidrolize sonucunda parçalanma ürünlerinin başlıcasının bir amino asit olduğu saptanmış ve tatlımsı lezzetinden dolayı glisin olarak adlandırılmıştır. Bu tarihten sonra 1935’te fibrinden treonin’in ayrılmasıyla proteinlerin yıkım ürünlerinden elde edilen amino asit sayısı 20 olmuştur. Amino asitlere önceleri bunları bulanlarca gelişigüzel adlar verilmiş ve bu adlar kimyasal adlandırma yerine günümüzde de yaygınlaşmıştır.
ÖZELLİKLERİ
Protein yapısına girmeyip insan ve hayvan vücudunda bulunan amino asitlerden taurin, kreştin, ornitin, sitrülin, homositrülin de günümüzde saptanmıştır. Bunlardan sitrüli-nin yalnız saç kökleri proteinlerinde kullanıldığı gösterilebilmiştir. Bunların dışında azoserin, sikloserin ve kloranfenikol gibi mikroorganizmalar tarafından yapılan amino asitler vücutta bulunmazlar.
Amino asitler tatlı lezzette, erime noktaları oldukça yüksek olan kristalize maddelerdir. Aynı zamanda hem baz ve hem de asit grubu taşıdıklarından hem asitlerle hem de bazlarla tuz oluştururlar. Böylece, asitli çözeltide katyon ve kalevi çözeltide anyon biçiminde bulunurlar. Bu tür maddeler amfoter elektrolit ya da amfolit olarak adlandırılır. Sulu çözeltide karboksil grubunun protonu amin grubu üzerine göçer ve bir iç tuz oluşturur. Amino asitlerin iç tuz yapısı fiziksel özelliklerine yansır. Bunlar oldukça yüksek erime noktası (230°C’nin üzerinde); bozunmadan damıtılamama; suda kolaylıkla alkolde güç ve eterle öteki organik çözücülerde hiç çözünmeme gibi özelliklerdir. Amino asitler kendilerine karşılık olan esterleri oluştururlar. Sodyum hidroksit-kalsiyum oksit karışımıyla ısıtıldıklarında amin oluşturarak bozunurlar. Sık rastlanan amino asitlerin kimyasal formülleri glisin (NH2CH2COOH) molekülünden türemiş gibi yazılabilir.
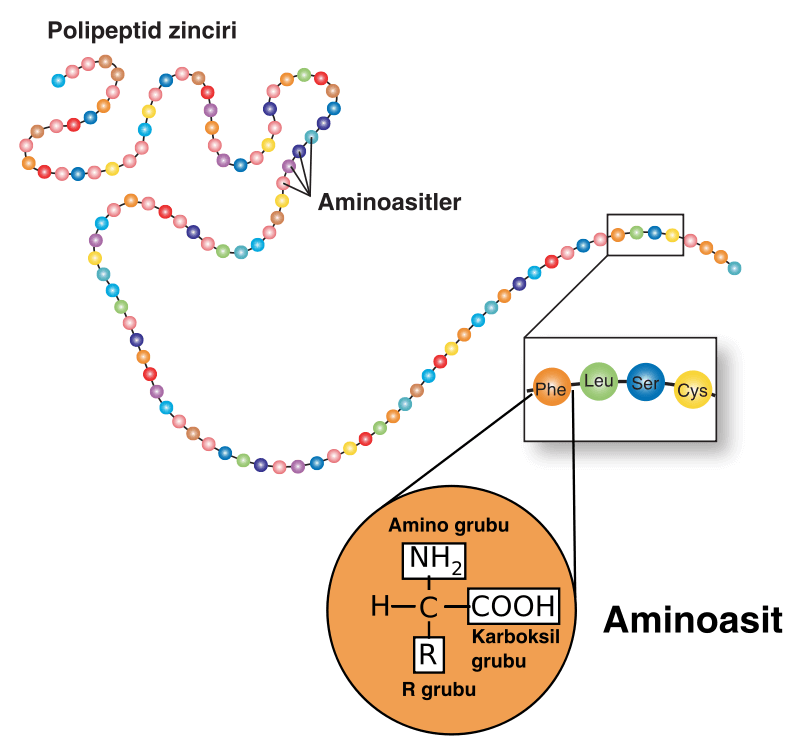
aminoasitlerin oluşturduğu bir polipeptid zinciri
Glisindeki CH2 grubunun hidrojenlerinden birinin yerine geçen R grupları her bir amino asidin bireysel özelliklerini verir. Bu R grupları yapılarına göre kimyasal bakımdan etkin olabilirler ya da olmayabilirler. Örneğin, sisteminde bulunan ve çok etkin olan sülfhidril grubu (-SH), proteinlerdeki disülfür (-S-S-) bağlarının oluşumunda önemli bir görev yüklenir. Lisin ve argininde bulunan ikinci bir amino grubu bunlara baz özelliği verir. Amino asitler ve özellikle doğada bulunan alfa-amino asitlerde karboksil grubuna komşu karbon atomuna bağlı dört tane farklı kimyasal grup için uzayda iki ayrı duruş düzeni olasıdır. Bu iki yapı birbirlerinin ayna görüntüsü olup optik izomerleri oluştururlar. Buna göre, amino asitler optikçe aktiflik gösterirler. Amino asitler için uzayda iki farklı düzenleniş olanağı olmakla birlikte proteinlerde bunlardan yalnız L- yapışma rastlanır. L- yapısının ayna görüntüsü olan D- izomerlerine doğada bazen rastlanmakla birlikte bunlar proteinlerin yapısında yer almazlar. D- amino asitler hücre ve sporların duvarları ile toprak bakterilerinin oluşturduğu antibiyotiklerin bileşiminde bulunmuştur. Örneğin gramisidin S, trosidin vb gibi antibiyotikler-deki D-fenilolonin ve D-lösin gibi.
ELDE EDİLMELERİ.
Doğal amino asitler proteinlerin parçalanma ürünleri arasından ayrılırlar. Bunun yanında -aminoasitlere karşılık olan- halojenli asitlerin amonyakla sırasıyla tepkimeye sokulmasıyla,

denklemi uyarınca ya da Strecker sentezine göre aminonitrillerin hidroliziy-le elde edilirler. Strecker sentezinde elde edilecek amino asidin R grubunun taşıyan aldekitten yola çıkılır. Önce aldekite siyanür asidi katılarak siyano-hidrin ve bunun amonyakla tepkimeye sokulmasıyla da aminonitril elde edilir. Aminoznitril derişik asitli ortamda hidrolizlenerek karşılık olan amino aside dönüştürülür.
AYRILMALARI VE TANINMALARI.
Amino asitler benzer kimyasal özelliklerde olduklarından bunların birbirlerinden ayrılması oldukça güçtür. Bununla birlikte, günümüzde geliştirilmiş olan çeşitli krematografik yöntemler yardımıyla amino asitler kolayca birbirlerinden ayrılabilmektedir. Bu yöntemlerin geliştirilmesi proteinlerin çözümlenmesine yeni boyutlar getirmiştir. Amino asitler renksiz olduklarından kromatografi plakları üzerine doğrudan görülemezler. Bunların görünür duruma getirilmesi için ninhidrin tepkimesinden yararlanılır. Amino asitler ninhidrin ile koyu mavi-menekşe bir renk verirler. Kromatografi plakları üzerine ninhidrin çözeltisi püskürtülünce amino asit lekeleri görünür duruma gelirler. Bazı besin proteinlerinde yeter miktarda olan özel yapılı amino asitlere eksojen (dışarıdan alınan) ya da esansiyel amino asitler adı verilir. Bunlar vücutta yapılabilen endojen amino asitlerin tersine mutlak dışarıdan alınması gereken amino asitlerdir. Eksojen esansiyel amino asitleri çok olan proteinler, biyolojik değeri yüksek proteinlerdir. Kazein ve birçok hayvansal proteinler böyledir. Bitkisel proteinlerse bu açıdan fakirdirler. Laboratuvar fareleriyle yaprlan çalrşmalar sonucunda esansiyel olan ve olmayan amino asitler şöyle sınıflanmıştır.
Esansiyel Amino Asitler
- Esansiyel Esansiyel olanlar(Eksojen) : Lizin, Tritofan, Histidin, Fenilalanin, Lösin, İzolosin, Valin, Metyonin, Treonin, Argşinin
- Esansiyel Olmayanlar (Endojen) : Tirozin, Sistin, Oksiprolin, Prolin, Glutomik asit, Aspartik asit, Serin, Alanin, Glisin
Esansiyel amino asitlerin alınma miktarları da insan sağlığı için önemlidir. Örneğin 8 amino asidin günlük en az alınması gereken dozları şu şekildedir:
- Triptofon 0.25 mg/gün
- Treonin 0.50 mg/gün
- İzolösin 0.70 mg/gün
- Lizin 0.80 mg/gün
- Valin 0.80 mg/gün
- Lösin 1.10 mg/gün
- Metiyonin 1.10 mg/gün
- Fenilalanin 1.10 mg/gün
Bir insanın normal büyümesi ve yaşamını sağlıklı sürdürülebilmesi yeterli ve dengeli beslenmesiyle olanaklıdır. Bu denge içinde amino asitler de en önemli paya sahiptirler.
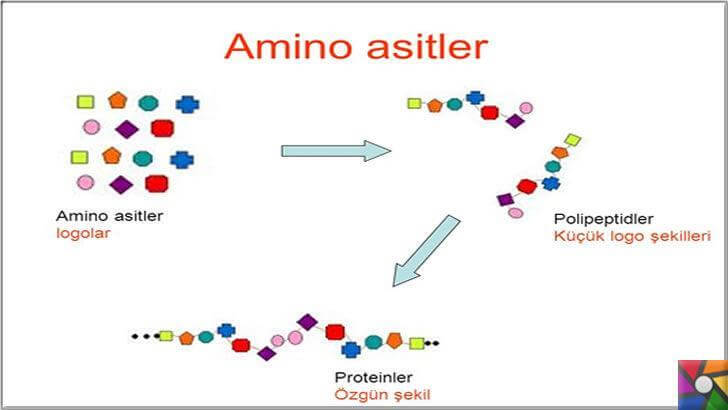
Peptid bağı. Proteinleri oluşturmak üzere birbirlerine bağlanan amino asitler arasında oluşan bağlara petid bağı adı verilir. Peptid bağının oluşumu sırasında bir amino asidin amino grubuyla öteki amino asidin karboksil grubu arasından bir molekül su ayrılır. İki amino asidin birleşmesiyle dipeptid, buna bir üçüncü amino asidin eklenmesiyle tripeptid, on tanesiyle dekopeptid (2-10 aminoasit arasındaki peptidlere dekapeptid adı verilir) oluşur ve işlemin sürmesiyle zincir biçiminde polipeptid yani protein molekülleri oluşur. Yaklaşık yüzün üstünde amino asidi olan peptidlere makropeptid adı da verilir.
Amino Asitlerin Yapısı Nasıldır? Proteinlerin Nasıl Oluşur?
Aminoasitler 20 çeşittir. Bu aminoasitlerin bir bölümü hücrelerde yapılır. Yapılamayanlar ise besinlerden alınır. Dışarıdan hazır olarak alınan bu aminoasitlere temel aminoasitler denir. Proteinlerin çoğu 20 çeşit aminoasitin hemen tümünü kapsar.
Her aminoasitte bir temel karbon atomu, bir amino grubu, bir karboksil grubu, bir H (hidrojen atomu) ile bir R grubu (radikal grup) vardır. Radikal “değişebilen” demektir. Radikali hariç bütün aminoasitler aynı yapıdadır. Bu duruma göre 20 çeşit aminoasitin oluşmasını, 20 çeşit radikalin bulunmasıyla açıklayabiliriz.
Aminoasitte radikal olarak H (Hidrojen) atomu bulunursa en basit aminoasit olan glisin, CH3 (metil grubu) bulunursa alanin aminoasiti oluşur. Öyle ise 20 radikali bilirsek bütün aminoasitleri bilmiş oluruz.
PROTEİNLER NASIL OLUŞUR?
Proteinler aminoasitlerin birleşmesi ile oluşur. Aminoasitler birbirlerine karboksil ve amino gruplarından bağlanırlar. Bağlanma olurken birinin amino grubundaki bir hidrojenle (H), ötekinin karboksil grubundaki OH (Hidroksil grubu) birleşir ve su olarak çıkar. Böylece iki aminoasit; birinin amino grubundaki azot (N), ötekinin karboksil grubundaki karbon (C) aracılığıyla birbirlerine bağlanırlar.
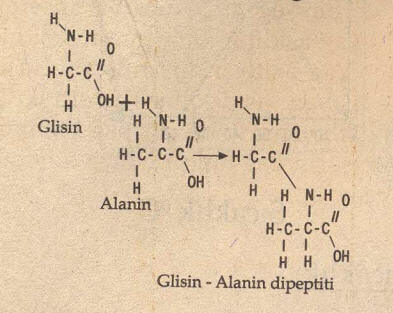
İki aminoasit arasında oluşan bu bağla. “peptit bağı” denir. Peptit bağı iki aminoasit arasına yapılmış ise oluşan bileşiğe “dipeptit“, üç aminoasit arasında yapılmış ise “tripeptit”, çok sayıda aminoasit arasında yapılmış ise “polipeptit” denir. Birleşen amino asit sayısı 50 ile 3000 arasında ise oluşan bileşiklere bu kez “protein” denir.
- n Aminoasit —Enzim → Protein + n – 1 H20
Aminoasitlerin dizilişi ve sayısı protein çeşitliliğini arttırır. örneğin, iki proteindeki aminoasit sayısı ve çeşitleri aynı olsa bile aminoasitlerin diziliş sırası farklı ise iki proteinin oluşabileceğini söyleyebiliriz.
Aminoasitlerin birleşip peptit bağı oluşturmaları sırasında su çıkar. Monosakkaritlerin birleşerek disakkarit ve polisakkarit, yağ asitleri ile gliserinin birleşip yağ oluşturmaları sırasında da su çıktığını anımsayacaksınız. Küçük moleküllü maddelerin birleşerek büyük bir molekül oluşturmaları sırasında su çıkışı oluyorsa, bu türlü kimyasal tepkimelere dehidrasyon sentezi denilir.
Birleşmiş iki aminoasiti, yani bir dipeptiti parçalamak için ne yapmalıyız?
Dehidrasyon sentezi sırasında iki aminoasit arasından çıkan suyu tekrar aminoasitlere vermemiz gerekmez mi? Verilen örnekteki gibi, bir büyük molekül ii küçük moleküllere parçalamak için, su katılması gerekiyorsa bu tür tepkimelere “hidroliz” denir. Sindirim sırasında; proteinleri, yağlan. nişasta gibi karbonhidratlı besinleri hidrolizle küçük moleküllere parçalarız.