Atom modelleri nelerdir? Atom modellerinin gelişimi, Bohr’un postülatı, Franck Hertz deneyi hakkında bilgi. Tüm atom modelleri tarihi sıralaması
Atom Modelleri
1896 yılında, J.J. Thomson, atomun temel parçacıklarından biri olan elektronu buldu. Bu parçacağın bulunuşundan sonra Thomson, bir atom modeli önerdi.
THOMSON ATOM MODELİ:
Bu modele göre atom yaklaşık metre çaplı küre biçimindedir. Pozitif yükler küre içinde düzgün olarak dağılmış, negatif yüklü elektronlar ise atomu elektrikçe nötr tutacak şekilde sıralanmışlardır. Bu elektronlar atomun kütlesinden binlerce defa daha hafif ve hareketsizdirler. Atomun kütlesinin tamamına yakın kısmını pozitif yükler meydana getirir. Thomson atom modeli Şekildeki gibi üzümlü kek modeline benzetilmiştir.
- ►Atom, yaklaşık olarak İO”10 metre çaplı bir küre şeklindedir.
- ►Pozitif yük, küre içinde homojen olarak dağılmıştır. Elektronlar, küre içinde atomu elektrikçe nötr durumda tutacak şekilde sıralanmışlardır.
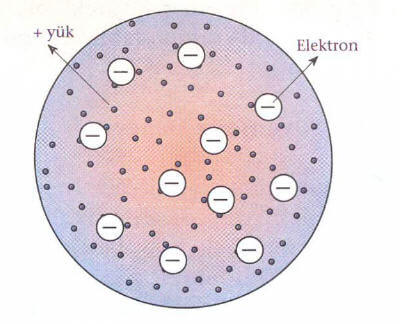
►Elektronlar atomda hareketsizdir. Thomson atom modeli yetersizdir. 1911 yılında Ernest Rutherford, ince altın yaprağını radyoaktif elementlerden çıkan ∝-ışınları ile bombardıman ederek atom yapısını anlamaya çalıştı.
RUTHERFORD ATOM MODELİ:
►Enerji korunumundan (b=0 için)
dan
değerlerinden çekirdeğin yarıçapı;
olmalıdır. Bu varsayıma göre, atomun hacmi
, yoğunluğu da
mertebesinde olmalıdır.
► α – parçacıklarının saçılma açısı θ için;
bağıntısı vardır.
Buna göre, daha ağır çekirdeklere, daha yavaş veya daha küçük kütleli ve kinetik enerjili pozitif parçacıklar gönderilirse, saçılma açısı artar.
θ saçılma açısı; b vurma parametrisi (nişan hatası) ile ters orantılıdır.
- ►Atom, ortada pozitif yüklü ağır bir çekirdek ve bunun çevresinde dönen negatif yüklü elektronları ile Güneş sistemine benzer.
- ►Nötr bir atomda; çekirdekteki pozitif yük sayısı kadar, çekirdeğin çevresinde dolanan elektronlar olmalıdır.
- ►Çekirdeğin çevresinde dolanan elektronlar ile çekirdekteki pozitif yükler arasında Coulomb çekim kuvveti vardır.
Elektromagnetik teoriye göre; ivmeli hareket yapan bir yük, ışıma yapar. O halde;
Rutherford atom modeline göre de çekirdeğin çevresinde ivmeli hareket yapan bir elektron sürekli ışıma yapmalıdır. Bunun sonucu olarak;
- i) Sürekli ışıma, atomların spektrum çizgilerinin sürekli olması gerektiğini öngörür.
- ii) Sürekli ışıma yapan elektronun enerjisi zamanla azalmalıdır. Bunun anlamı elektronun frekansı zamanla artmalı yani elektron, çekirdeğin çevresinde spiral bir eğri çizerek dolanmalıdır.
FRANCK-HERTZ DENEYİ:
1914 yılında Franck ve Hertz, civa buharını hızlı elektronlarla bombardıman ettiler. Kendilerine Nobel ödülünü kazandıran bu deneyde şu sonuçlar elde ettiler:
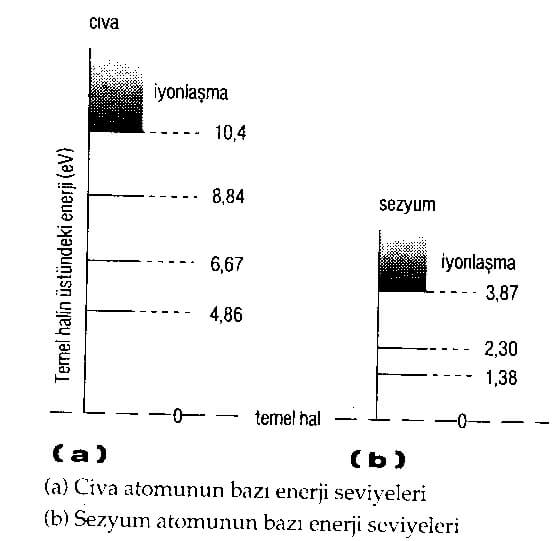
►Civa gibi her atomun kendine özgü belli ve kesikli enerji düzeyleri vardır.
Civa atomlarının soğurduğu ve yaydığı enerjiler 4.86 eV 6.67 eV, 8.84 eV ve 10,4 eV enerjilere karşılık geliyor. Aynı şekilde sezyumun enerji düzeyleri de 1.38 eV, 2.30 eV ve 3.87 eV dir.
BOHR ATOM MODELİ:
Danimarkalı fizikçi Niels Bohr 1913 yılında Rutherford’un Atom modelini temel alarak bir atom modeli önerdi.
Atomların kesikli, çizgi spektrumlarının açıklanabilmesi için, elektronların çekirdeğin çevresinde belli dairesel yörüngelerde dönmeleri gerektiğini ileri sürdü ve şu postülatlarla durumu açıklamayı başardı.
BOHR’UN I. POSTÜLATI:
Elektronlar; çekirdek çevresinde açısal momentumu , (L), h/2π nin tam katları olan kararlı yörüngelerde ışıma yapmadan dolanırlar. Yani;
dir.
- Burada n = 1,2 ,3 ,…. ve
- h = 6,62 x 10-34 joule x saniye değerine sahip Planck sabitidir.
BOHR’UN II. POSTÜLATI:
Bir elektron, yüksek enerjili kararlı bir yörüngeden, daha düşük enerjili kararlı bir yörüngeye kendiliğinden geçebilir. Bu geçiş sırasında atomdan bir foton yayılır. Yayılan fotonun frekansı elektronun ilk ve son yörüngelerdeki enerji farkı ile belirlenir. Yani;
dür.
Bohr atom teorisi bir elektronlu
(H, He+ ve Li++;…. gibi) atomların spektrum çizgilerini açıklamada başarılıdır. Bohr postülatlarından şu önemli sonuçlara varılabilir:
1) Çekirdeğin etrafında dolanan elektronların ışıma yapmadan dolanabileceği yörüngelerin yarıçapı,
bağıntısından bulunur. Burada n = 1,2,3,4, …. değerlerini alabilir.
0,53 Angström = 0,53 x metre değerine “Bohr yarıçapı” denir. z ise atom numarasındadır.
2) Çekirdeğin çevresinde dairesel bir yörüngede dolanan elektronların enerjisi (elektron volt cinsinden) bağıntısı ile hesaplanabilir.

UYARMA:
Bohr’un I. Postülatı; atomda elektronların ışıma yapmadan dolanabileceği belli ve kesikli enerji düzeyleri olduğunu gösterdi.
3) Bohr’un II. Postülatı da kullanılarak hidrojen atomunun spektrum serileri açıklanabilir.
Hidrojen Atomunda elektron, yüksek enerjili (Ei) bir yörüngedendüşük enerjili (Es) bir yörüngeye geçerken yayılan fotonun dalga boyu (veya frekansı) bağıntısından hesaplanabilir.
(Buradaki R = 13,6 eV c ışığının boşluktaki hızı, h da planck sabitidir)
Elektronun değişik dış yörüngelerden aynı bir iç yörüngeye geçmesiyle yayılan ışımalar Hidrojen atomunun spektrum serilerini verir.