Atomik Bağ nedir? Atomik bağ çeşitleri nelerdir? İyonik bağlar, kovalent bağlar ve metalik bağlar nasıl oluşur, özellikleri, iyonlar hakkında bilgi.
Atomlar ve iyonlar birbirleriyle üç ana şekilde bağlanır – iyonik bağlar, kovalent bağlar ve metalik bağlar. Farklı bağ türleri, farklı yapılar – kafesler ve moleküller – oluşturur.
İyonlar
Atomlar, tam bir dış sıra oluşturmak için elektron kaybetme veya kazanma eğilimindedir.
İyon, yüklü bir parçacıktır. Atomlar, tam bir dış sıra oluşturmak için elektronları kazandığında veya kaybettiğinde oluşurlar. İyonlar yüklüdür, çünkü proton sayısı elektron sayısından farklıdır.
Moleküler iyon, genel olarak pozitif veya negatif bir yüke sahip birden fazla atomdan yapılmış bir parçacıktır.
- Negatif yüklü iyona anyon denir.
- Poztik yüklü iyonuna katyon denir.
Basit iyonların tam dış kabukları ve asal gazların kararlı elektronik konfigürasyonu vardır.
Negatif ve pozitif iyonlar oluşturma
Negatif iyon (anyon) oluşturma
Atomlar, anyon adı verilen negatif iyonlar oluşturduklarında dış kabuklarında elektronlar kazanırlar. Bu iyonlar negatiftir çünkü protonlardan daha fazla elektron içerirler.
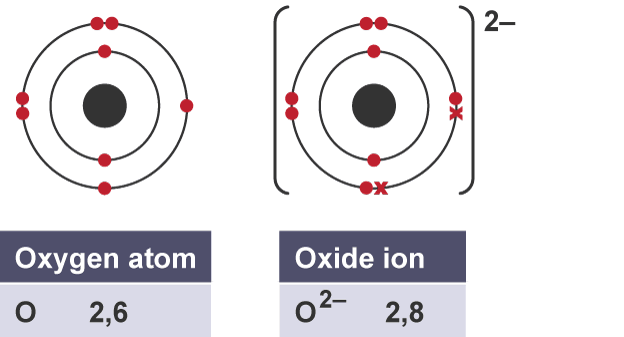
Pozitif iyonlar (katyonlar) oluşturma
Atomlar, katyon adı verilen pozitif iyonlar oluşturduklarında dış sıralarındaki elektronları kaybederler. Bu iyonlar pozitiftir çünkü elektronlardan daha fazla proton içerirler.
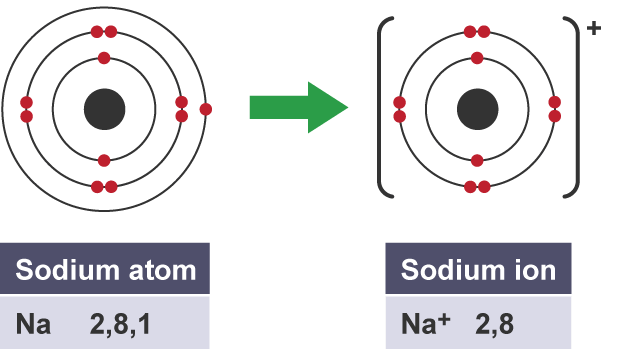
Bağlar
üç tür bağ vardır:
- İyonik bağ
- Kovalent bağ
- Metalik bağ
İyonik bağ
İyonik bağ, metal olmayan (genellikle bir Grup 6 veya 7 elemanı) ile olan bir metal (genellikle bir Grup 1 veya 2 element) içeren bileşikler arasında meydana gelir. Metal bileşikleri oluşturmak için bağlanırlar.
İyonik bir bileşik oluştururken:
- elektronlar metal atomundan metal olmayan atoma aktarılır.
- bu zıt yüklü iyonlar oluşturur.
- metal iyonu pozitif bir yüke sahiptir.
- metal olmayan iyonun negatif bir yükü vardır.
- iyonik bir bağ, bu karşıt yüklü iyonlar arasındaki çekimdir.
- iyonik bağ güçlüdür ve kırılması için önemli miktarda enerji gerektirir.
İyon oluşumunu göstermek için nokta ve çapraz diyagramlar
Nokta ve çapraz diyagramlar iyonların atomlardan oluştuğunu modellememize yardımcı olur.
İşte sodyum ve klor kullanan bir örnek. Sodyum klorür oluşturmak üzere bağlanan iyonlar oluştururlar.
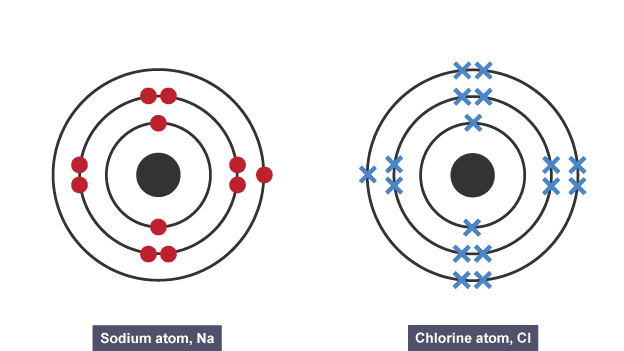
- Her atomun elektronik konfigürasyonunu çizin – bir eleman noktalı, diğeri çarpı işaretli.
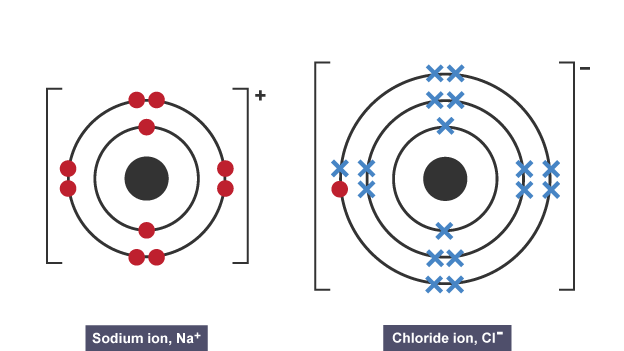
- Kaç elektronun aktarılması gerektiğini öğrenin.
- Elde edilen iyonların elektron konfigürasyonunu çizin.
- Her iyonun yükünü yazın.
Kovalent bağlar
Soygaz konfigürasyonu elde etmek için iki atom elektronları paylaştığında kovalent bir bağ oluşur. Metal olmayan atomlar arasında kovalent bağ oluşur. Kovalent bağlar güçlüdür ve kırılması için önemli miktarda enerji gerektirir.
- Kovalent bağ: paylaşılan bir çift elektron.
- Molekül: iki veya daha fazla atom, kovalent olarak birbirine bağlanır.
- Diatomik: bir molekülde kovalent olarak birbirine bağlanmış iki atom.
,
ve
, diatomik moleküllerin örnekleridir.
Kovalent bağ için nokta ve çapraz diyagramlar
Bir çift elektronun nasıl bir kovalent bağ oluşturduğunu göstermek için nokta ve çapraz diyagramları kullanabiliriz.
İşte bir diyatomik molekül olan oksijen () için nokta ve çapraz diyagram. Paylaşılan elektron çiftine dikkat edin.
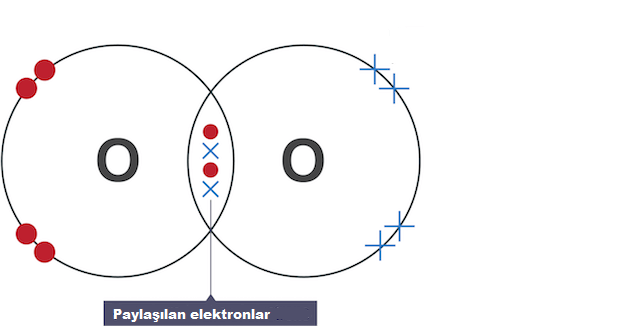
Farklı türlerde kovalent bağlar vardır:
- tek bir kovalent bağ, iki atomun tek bir elektron çiftini paylaşmasıdır. Tek bir satırla (-) temsil edilir.
- çift kovalent bağ, iki atomun iki çift elektron paylaşmasıdır. Bir çift çizgi ile temsil edilir (=).
- üçlü kovalent bağ, iki atomun üç çift elektron paylaşmasıdır. Üçlü bir çizgi ile temsil edilir (≡).
Metalik bağlar
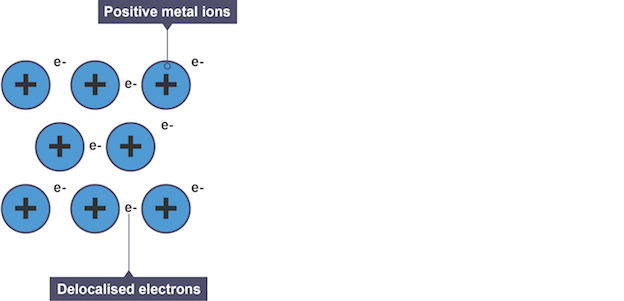
Metalik bağ, düzenli bir kafes içindeki pozitif iyonlar ve delokalize elektronlar arasındaki çekimdir. Delokalize elektronlar tüm yapı boyunca hareket etmekte serbesttir.
Bir metalin yapısının şemasını çizerken, iyonları normal sıralarda çizdiğinizden emin olun.