Bazların Kuvvetliliği nedir? İyonik bağlı bazların ve kovalent bağlı bazların kuvveti, kuvvetliliği nedir, özellikleri hakkında bilgi.
Bazların Kuvvetliliği
Bazların kuvvetlilikleri iki farklı şekilde değerlendirilir.
a. İyonik Bağlı Bazların Kuvveti
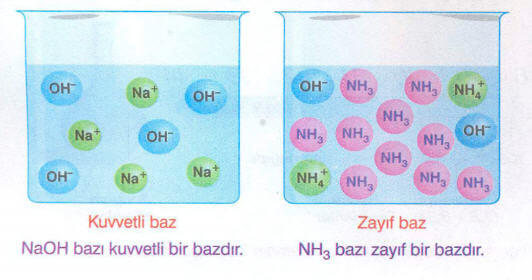
Bir metal katyonunun, hidroksit iyonu ile oluşturduğu bileşikler bazdır ve iyonik bağlıdır. İyonik bağlı bir bileşik suda çözündüğünde tamamen iyonlaşır. Yani oluşan sulu çözeltide iyonların dışında baza ait moleküller yoktur.
Yukarıda verilen iyonlaşma denklemlerinde çözünen ve iyonlaşan maddeler suya iyonu verdiklerinden dolayı bazdır. Bu bileşiklerin tümü iyonik bağlıdır. Yani çözünen katıların tamamı iyonlarına ayrılmıştır.
Not: İyonik bağlı bazların kuvvetlilikleri iyonlaşma oranlarına göre belirlenmez. Katının çözünmesi ile oluşan doygun çözeltilerinin birim hacimlerinde oluşan iyon sayılarına göre bazlık kuvveti belirlenir. Bu da baz bileşiğinin sudaki çözü-nebilen miktarı ile doğru orantılıdır.
Kısacası iyonik bağlı bazlarda (metal hidroksit) bazın suda çözünebilen miktarı ne kadar büyük ise bazlık kuvveti de o kadar büyük olur.
***Alkali metallerin (Li, Na, K gibi)) oluşturduğu bazların ve toprak alkali metal olan Ba elementinin oluşturduğu bazlar suda oldukça iyi çözünürler. Yani suda oluşturdukları iyon miktarları fazla olur. Bu nedenle LiOH, NaOH, KOH ve
bazları kuvvetli bazlardır.
***Bunların dışındaki bütün metallerin oluşturduğu bazların sudaki, çözünürlük değerleri küçük olduğundan sulu çözeltilerinde oluşturacakları iyon sayıları az olduğundan zayıf bazlardır.
Buna göre , AgOH ve
,
katılarının oluşturacağı sulu çözeltiler zayıf baz özelliği gösterir.
b. Kovalent Bağlı Bazların Kuvveti
Molekülllerinin yapısında iyonu içermemesine rağmen sulu çözeltisinde
iyonu oluşturan maddeler de (proton alan) bazdır. Bu tür bazların kuvveti, aynı asitlerin kuvvetindeki gibi suda çözündüklerinde iyonlaşma oranlarına göre belirlenir. Ancak kovalent bağlı bazların tamamı zayıf bazdır. Sadece kendi aralarındaki bazlık kuvvetlerinin karşılaştırılması için kullanılır.
Yukarıda verilen iyonlaşma denklemlerine göre (amonyak) ve
(Metil amin) bileşiklerinin ikisi de bazdır. Her ikisinin de 0,1 er mol çözünmüş madde içeren 1 er litrelik sulu çözeltisinde
ün % 1,5 ve
nin ise % 6,6 iyonlaştığı hesaplanmıştır. Yani
bazı,
bazından daha kuvvetlidir. Ancak bu bazların her ikisi de az iyonlaştıklarından dolayı zayıf bazlardır.