Azotun inorganik bileşikleri nelerdir? İnorganik azot bileşiklerinin özellikleri ve kullanımları hakkında bilgi.

İnorganik Azot Bileşikleri; İki ana inorganik azot bileşiği, amonyak ve nitrik asittir. Bir dizi madde ya onlardan yapılır ya da bunlarla yakından ilişkili olarak kabul edilebilir.
Amonyak.
Amonyak, NHS formülüne sahiptir ve insanoğlunun bildiği en eski nitrojen bileşiklerinden biridir ve orijinal olarak hayvanların boynuzları gibi organik maddelerin yıkıcı damıtılmasıyla üretilmiştir. Kömürün karbonizasyon prosesinin gelişmesiyle birlikte, amonyak kömür gazından temizlendi ve önemli bir ticari kimyasal haline geldi. Endüstride, amonyak neredeyse tamamen azot ve hidrojenin 200 ila 1000 atmosfer arasındaki basınçlarda ve 450°C arasındaki sıcaklıklarda doğrudan kombinasyonu ile yapılır. ve 700°C. destekleyici olarak diğer elementleri içeren bir demir katalizörün varlığında.
Amonyak normal sıcaklıklarda bir gazdır, ancak -33.4°C’de sıvılaşır ve genellikle silindirlerde ve tank arabalarında işlenir, sıvı 25°C’de yaklaşık 10 atmosfer basınç altındadır. Suda son derece çözünür, ticari ürün “aqua amonyak” olarak bilinir, yüzde 28’lik bir çözelti.
Gaz halindeki amonyak doğrudan toprağa verilebilir, ancak daha yaygın olarak ticari gübrenin bir amonyum tuzu formundaki bir bileşenidir. Sıvı amonyak, esas olarak büyük tesislerde kullanılan endüstriyel bir soğutucudur. Başlıca kullanımı, bir dizi endüstriyel kimyasalın üretiminde bir başlangıç maddesidir. Bunlara amonyum sülfat, amonyum nitrat, amonyum klorür, amonyum fosfatlar, üre ve sülfamik asit dahildir.
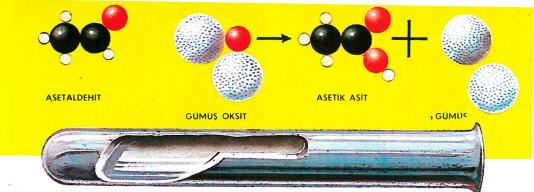
Aldehitler amonyak eriyiğinde erimiş gümüş oksidi indirgeyebilirler. Gümüş çöker, eğer cam çepere yapışırsa gümüş aynası olur
Hidrazin.
Alman kimyager Theodor Curtius tarafından 1887’de izole edilen hidrazin, NH2NH2 formülüne sahiptir ve amonyak ile hidrojen peroksitin, H2O2’nin su ile olan ilişkisinin aynısına sahip olduğu kabul edilir. İkinci Dünya Savaşı’na kadar hidrazin öncelikle bir laboratuvar kimyasalıydı. Birkaç yıl içinde hidrazin, kimya endüstrisinin büyük ölçekli bir ürünü haline geldi. Kauçuk endüstrisinde doğrudan köpürtücü ajan olarak, metal filmlerin cam ve plastikler üzerine yerleştirilmesinde indirgeyici ajan olarak ve roket yakıtı olarak kullanılmasına ek olarak, lehim fluksları, bitki büyüme geciktiricileri ve antitüberküloz ilaçları için bir başlangıç maddesidir ve diğer farmasötikler. Hidrazin sentezi, klor ve kostik soda ile başlar, ardından ortaya çıkan hipokloritin amonyakla işlenmesi sağlanır. Seyreltik çözeltiden susuz hidrazin elde edilir. (Ayrıca bkz. Hidrazin.)
Hidroksilamin.
Bu madde NH2OH formülüne sahip zayıf bir bazdır. Yüzde SO sülfürik asit çözeltisinde nitratların elektrolitik indirgenmesiyle tuz olarak üretilir. Hidroklorür ve sülfat formunda ticari bir kimyasaldır ve sentezde reaktif olarak ve yağ asitlerinde antiseptik, fotografik geliştirici ve oksidasyon inhibitörü olarak kullanılır.
Hidrazoik Asit
Zehirli ve oldukça patlayıcı bir asit, formülü HN3’tür ve hidrazinin organik bileşiklerin esterleri üzerindeki etkisiyle, ardından nitröz asitle muamele edilerek yapılır. Sodyum azid, NaNs, gümüş azid, AgNa gibi metallerle tuzlar oluşturur ve son olarak patlayıcı endüstrisinde önemli bir fünye olan kurşun azid Pb(N3)2 ile tuzlar oluşturur. Bkz. Kurşun Azide.
Nitrürler
Azot, bir dizi serbest elementle reaksiyona girerek, nitrojenin değerliliğinin üç olduğu nitrürleri oluşturur. Örneğin, magnezyum havada yakıldığında, magnezyum okside ek olarak belirli bir miktarda magnezyum nitrür Mg3N2 oluşur. Diğer tipik nitrürler arasında lityum, kalsiyum, bor, alüminyum, silikon, titanyum ve krom bulunur. Bunlardan bor nitrür, endüstriyel olarak en önemlisidir ve mükemmel bir refrakterdir. Magnezyum, atmosferin nadir gazlarının keşfine yol açan araştırmalarda kullanıldığında, bu gazların bir karışımından nitrür oluşturarak azotu uzaklaştırdı. Ancak, sıvı havanın damıtılması ve nadir gazların aktif karbon tarafından adsorbe edilmesi işlemlerinin geliştirilmesi bu tekniğin yerini almıştır.
Metal Amitler
Aktif metaller ve daha az aktif olan birkaç diğer metal, amonyak ile amidler oluşturur; en önemlisi, kimyasal sentezde yaygın olarak kullanılan sodamit NaNH2’dir.
Azot Halidler
Klor, amonyum klorür ile reaksiyona girerek patlayıcı, yağlı bir sıvı olan nitrojen triklorür, NCl’ler oluşturur. Bir gaz olarak ve hava ile büyük ölçüde seyreltildiğinde, bu madde değerli bir ağartma maddesidir. Daha düşük florürler, NF2 ve N2F2 de yapılmıştır. Nitrojen iyodür olarak bilinen, NI« ■ 2 NH3 formülüne sahip karmaşık bir bileşiktir. Sadece ıslandığında kararlı olan bu madde, kuruduktan sonra hareketli bir katı nesne ile en ufak bir temasta patlar ve bir tüyün dokunuşuyla harekete geçebilir.
Azot Oksitler
Beş azot oksidinin tamamı, doğrudan veya dolaylı olarak nitrik oksitten, NO’dan türetilir; bu oksitlerin kimyası, artan oksijen içeriği sırasına göre alınmasıyla en iyi şekilde anlaşılır.
Nitröz Oksit, N20, – 88.S°C’de sıvılaşan renksiz ve neredeyse kokusuz bir gazdır. ve güçlü çelik silindirlerde sıvı olarak satılır, buhar basıncı 20°C’dir. 50 atmosfer olmak. Suda oldukça çözünür ve solüsyonu hafif tatlı bir tada sahiptir. Azot oksit, amonyum nitratın hafifçe ısıtılmasıyla yapılır: NH4NOa = N2O + 2 H2O. Bu reaksiyonda açığa çıkan ısı miktarı büyük değildir, ancak nitröz oksidin nitrojen ve oksijene ayrışmasına çok daha fazla ısı eşlik eder ve amonyum tuzunun hızlı ve yoğun ısınması ciddi bir patlamaya neden olabilir. Nitröz oksit, oksijenin serbest kalmasıyla kolayca parçalandığından, serbest oksijenin varlığı için kullanılanla aynı teste, yani gaza verildiğinde parlayan bir kıymığın aleve dönüşmesine yanıt verir.
Nitröz oksidin başlıca kullanımı anesteziktir. Lokal anestezinin geliştirilmesinden önce diş hekimliğinde günümüze göre daha yaygın olarak kullanılıyordu. Halen cerrahide yaygın olarak kullanılan anestezikler arasındadır. Bilincin kaybolmasından önceki etkilerinden biri, neşe veya hafif bir histeri olduğu için, bu madde uzun zaman önce “gülme gazı” adını almıştır.
1801’de Sir Humphry Davy, nitröz oksidin uzun süreli inhalasyonda duyarsızlık oluşturduğunu gözlemledi ve ameliyatta kullanılmasını önerdi. Hartford, Conn.’de diş hekimi olan Dr. Horace Wells’in diş cerrahisinde anestezik olarak nitröz oksit kullanmasının üzerinden kırk yıldan fazla zaman geçmişti.
Bu maddenin bir başka ilginç ama önemsiz kullanımı, bir kapta krema içinde hafif basınç altında eritilmesidir. Valf açıldığında, hızlı çalkalama veya “çırpma” yoluyla mekanik hava dahil edilmesiyle elde edilenle aynı kıvamda bir köpük üretilir.
Nitrik Oksit, NO, -1S2°C’de sıvılaşan renksiz bir gazdır. ve -164°C’de katılaşır. ve suda sadece az çözünür. En çarpıcı özelliği, soğukta oksijenle birleşmeye hazır olmasıdır; 150°C’nin altındaki herhangi bir sıcaklıkta hava ile karışımı. anında kombinasyonla sonuçlanır: 2NO + O2 = 2N02. Daha yüksek sıcaklıklarda elde edilen nitrojen dioksit ayrışır ve 620°C’de reaksiyon tamamen tersine çevrilir. Nitrik oksit, bazı tuzlarla kararsız bileşikler oluşturur; demir sülfatlı ilave bileşik, kahverengi bir renge sahip olan FeS04 ■ NO, nitratların mevcudiyeti için bir testtir, demir sülfat ilk önce beş değerlikliyi iki değerli nitrojene indirger.
Nitrik oksit, sülfürik asit çözeltisinde demir sülfatın nitrik asit üzerindeki etkisiyle oldukça saf halde yapılır. Yüzde 30 ila 35 oranında nitrik asit bakır ile reaksiyona girdiğinde oluşan azotun ana oksididir. Endüstriyel olarak, ısıtılmış platin gazlı bez üzerinden amonyak ve hava karışımı geçirilerek miktar olarak üretilir: 4NH3 + 50_2 = 4NO + 6H2O. Bu şekilde oluşan nitrik oksit genellikle düşük sıcaklıklarda nitrojen dioksite, N02’ye oksitlenir. Oksijen ve nitrojenin 2500°C ila 3200°C sıcaklıklardaki bir elektrik arkında doğrudan kombinasyonu, ardından gazın hızlı soğutulması, 700°C’deki gazın bir gaz içerdiği yeterli ölçüde nitrik oksit oluşumuyla sonuçlanır. bu oksidin yüzde I’in biraz üzerinde. Ark, ya bir manyetik alanla ya da gazın özel nozullar aracılığıyla verilmesiyle yayılır. Bu süreç, su gücünün ucuz elektrik akımı ürettiği Norveç’te başarılı bir şekilde yürütüldü, ancak şimdi küçük bir öneme sahip. Hidrokarbon gazlarını yakarak daha önce yoğun ısıya maruz kalan refrakter malzeme üzerinden hava geçirerek nitrik oksit yapmanın mümkün olduğu kanıtlanmıştır. Bu sürecin daha da geliştirilmesi, büyük ölçüde ekonomik hususlara bağlıdır. Nitrik oksit, esas olarak nitrik asit üretiminde kullanılır.
Azot Trioksit, N2O’lar. Düşük sıcaklıkta nitrojen trioksit, —103°C’de donan mavi bir sıvıdır. ve 3.5°C’de bozunma ile kaynar. Normal sıcaklıklarda nitrojen dioksit bağımsız olarak var olamaz ve nitrik oksit ile nitrojen dioksitin eş moleküler bir karışımı olarak kabul edilebilir: N2O3 = NO + NOa. Bu karışım, sülfürik asit üretimi için nitrasyon veya kurşun odalı proseste oksijenin taşıyıcısıdır (bakınız Sülfür, Sülfürik Asit Uygulamaları). Nitröz asit HNO2’nin anhidritidir ve suda çözündüğünde bu asidi oluşturur.
Azot Dioksit, N02(ve Azot Tetrox-ide, N2O1). Bu madde, keskin ve tahriş edici bir kokuya ve sıcakken koyu kırmızımsı kahverengi bir renge sahip zehirli bir gazdır, rengi daha da yüksek sıcaklıklarda neredeyse siyah hale gelir. Oksijen ve nitrik okside ayrışma yaklaşık 150°C’de başlar. ve 620°C’de tamamlanıncaya kadar devam eder. Azot dioksit gazı soğudukça, azot tetroksite (bazen dinitrojen tetroksit olarak da adlandırılır) polimerleşmeye başlar, N204. Sıvılaşma noktasında, 21.1 °C’de, sarı sıvı esas olarak bu polimerden oluşur. Azot dioksit, soğukta havadaki oksijenin nitrik oksit üzerindeki etkisiyle niceliksel olarak oluşur ve ayrıca konsantre nitrik asit ile bakır, cıva ve gümüş gibi metaller arasındaki reaksiyonun ana ürünüdür. Azot dioksit, nitröz asit, HNO2 oluşturmak için soğuk su ile reaksiyona girer, ve nitrik asit, HNO3. Önceki asit kararsızdır ve absorpsiyon sırasında su soğuk tutulmazsa, net sonuç 3 N02 + H20 = 2 _ HNOs + NO denklemi ile temsil edilir. Azot dioksit, esas olarak nitrik asit üretiminde bir ara maddedir, ancak organik kimya endüstrisinde bir oksidasyon ve nitratlama maddesi olarak kullanılır.
Nitrojen Pentoxide,N2Os, 30°C’de eriyen beyaz kristal bir katıdır. ve 50°C’de kendiliğinden parçalanır. nitrojen dioksit ve oksijene dönüşür. Bu oksit, fosfor pentoksitin susuz nitrik asit üzerindeki etkisiyle üretilir. Pentoksitin kaçması ve su buharı ile reaksiyona girmesi nedeniyle nemli havada konsantre nitrik asit dumanları çıkar . Pentoksitin ticari kullanımı yoktur.
Azot-Oksijen Asitleri
Azot, oksijen ve hidrojen içeren altı asit vardır, ancak bunlardan sadece üçü önemlidir.
Hiponitröz Asit, H202N2, HO—N=N—OH yapısına sahip olarak kabul edilir. Kararsız beyaz bir katıdır. Sodyum nitrit, NaN02, serbest asidin elde edilebildiği sodyum amalgam tarafından sodyum hiponitrite indirgenir. Ne asit ne de tuzları endüstriyel değere sahip değildir.
Nitröz Asit, HN02, hiçbir zaman serbest halde izole edilmemiştir, ancak bir asidin sodyum nitritin seyreltik çözeltileri üzerindeki etkisiyle çözelti halinde oluşturulabilir, asit tarafından mavi bir renk verilir. Isınma, asidin nitrik asit, nitrik oksit ve suya parçalanmasına neden olur. Nitröz asit çözeltileri, aktif oksitleyici ajanlardır, iyodürlerden iyot salan ve kolay oksidasyon yapabilen organik bileşiklerle kolayca reaksiyona giren maddelerdir. Permanganatlar gibi güçlü oksitleyici maddelerle, nitröz asit bir indirgeyici madde olarak işlev görür.
Nitröz asit çözeltilerinin başlıca değeri, sentetik organik kimya endüstrisinde, özellikle boya imalatındadır. Boyaların önemli bir yüzdesi, azo grubu -N=N- ile karakterize edilen sınıflara aitken, az bir kısmı -NO grubunu içeren nitrozo bileşikleridir. Diğer nitroso bileşikleri boya ara maddeleridir. Bu maddeler, asit çözeltisinde sodyum nitritten gelen nitröz aside bağlıdır.
Azot asitlerinin en önemlisi olan Nitrik Asit, HNO’lar bilinen en eski inorganik kimyasallardan biridir (9. yüzyıldan beri). Simyacılar tarafından verilen ilk adı “aqua fortis” veya “kuvvetli su” idi. Saf hidrojen nitrat, —41.6°F’de katılaşan renksiz bir sıvıdır (özgül ağırlık 1.S4). 83°C’de bir miktar bozunma ile damıtılır. atmosferik basınçta. Ticari nitrik asit, yaygın olarak, normal sıcaklıklarda yüzde 12’ye kadar çözünür olan çözünmüş nitrojen dioksitin mevcudiyeti ile renklendirilir. Nitrik asit ve su, yüzde 68 nitrik asit ve yüzde 32 sudan oluşan sabit kaynayan bir karışım oluşturur; kaynama noktası 110°C’dir. 760 mm’de. (milimetre) basınç. Sodyum nitrat ve sülfürik asit karışımının ısıtılmasıyla yüzde 100’e kadar nitrik asit konsantrasyonları yapılabilir, ancak nitrojen dioksitin su içinde emildiği yaygın ticari işlem, yaklaşık yüzde 60 konsantrasyonda bir asit verir. Konsantre sülfürik asit ilavesi ve ısıtma, yüzde 90 ila 95 asit üretir.
Nitrik asit güçlü bir oksitleyici ajandır; oksidasyon potansiyeli çözeltilerinin konsantrasyonuna bağlıdır. Reaksiyonların seyri ve nihai ürünleri ayrıca nitrik asidin reaksiyona girdiği maddelerin indirgeme potansiyellerine de bağlıdır. Nitrik asidin indirgeme ürünleri arasında nitrojen dioksit, nitrik oksit, nitröz oksit, nitrojen ve amonyak bulunur. Genel olarak sadece iki ana ürünün, nitrik oksit ve amonyum iyonu, NH4+ olduğu, diğer maddelerin ikincil reaksiyonlarla oluştuğu kabul edilir. Seyreltik nitrik asit ve magnezyum, hidrojen ve nitrik oksit gibi aktif metaller içeren ürünlerdir. Çinko ve demir gibi biraz daha az aktif metaller amonyum iyonu üretir. Sadece bakır, gümüş ve cıva gibi orta derecede aktif metaller nitrik oksit verir, asit yüzde 25 ila 45 konsantrasyondadır. Yüzde 60 ila 68’lik bir asit, nitrojen dioksit üretir. Bu fark, 3 NO2 + H20= 2 HNOs + NO reaksiyonuyla açıklanır. Suyun konsantrasyonu, daha seyreltik asitte olduğu gibi yüksekse, ürün nitrik oksittir, daha yüksek nitrik asit konsantrasyonu ise nitrik oksidi nitrojen dioksite oksitler. Tüm bu durumlarda bir metalik nitrat oluşur. Kalay, antimon, tungsten ve molibden gibi oksitleri çözünmeyen metaller, nitratlarından ziyade bu oksitlerin oluşumu ile nitrik asit tarafından reaksiyona girer. Çok düşük indirgeme potansiyeline sahip bazı metaller nitrik asitten etkilenmez, bunlardan bazıları altın, indiyum, rodyum ve platindir. Alüminyum ve krom gibi bazı metaller bir oksit kaplama ile korunur ve bu nedenle nitrik asidin etkisine direnir.