Kimyasal tepkimelerde enerji çeşitleri, endotermik ve ekzotermik tepkimeler, alınan verilen enerji denklemleri, tepkime entalpisi konu anlatımı

Kaynak: pixabay.com
KİMYASAL TEPKİMELERDE ENERJİ
- Sistem: Evrenin belirli bir sınırla ayrılmış, incelenen parçasına denir.
- Çevre: Evrenin sistem dışında kalan kısmına çevre denir.
- Çevre ile ısı ve madde alışverişi yapan sistemlere AÇIK SİSTEM denir.
- Çevre ile ısı alışverişi yapan fakat madde alışverişi yapmayan sistemlere KAPALI SİSTEM denir.
- Çevre ile ısı ve madde alışverişi yapmayan sistemlere YALITILMIŞ (İZOLE) SİSTEM denir.
Kimyasal tepkimelerin tümünde enerji değişimi olur. Bu enerji değişimi kendini ısı, elektrik ve mekanik enerji, iş gibi değişik türlerde belli eder. Enerji değişiminin hangi türde ortaya çıkacağı seçilen koşullara bağlıdır.
ÖRNEK:
Mazot, açıkta veya sobada yakılırsa; oksijenle kimyasal tepkimeye girerek ısı enerjisi verir. Mazot dizel motorunda yakılırsa enerji değişiminin bir kısmı mekanik iş, bir kısmı ise ısı enerjisi şeklinde ortaya çıkar.
BAĞLARIN KIRILMASI ve OLUŞMA ISILARI
Bağ Koparma enerjisi: İki atomlu bir molekülde atomlar arasındaki bağın koparılması için gereken enerjidir. Mol başına k.kal olarak verilebilir.
► İki atom arasındaki bağı koparmak için çevreden enerji verilir.
► Bağ oluşumu sırasında çevreye enerji verilir.
ÖRNEK:
► (H-H) H atomları arasındaki çizgi bağı gösterir. (H-H)g → 2H
H atomları arasındaki bağı koparırken 1 mol başına 104 k.kal çevreden moleküle enerji verilir.
H atomları molekülü oluşurken mol başına çevreye 104 k.kal’lik enerji verilir.
► Aynı molekül için bağ oluşumu sırasında çevreye verilen enerji, bağ koparılması sırasında çevreden alınan enerjiye eşittir.
► Bağ koparmak için verilmesi gereken enerji ne kadar büyükse molekül veya bileşik o kadar kararlıdır.
► Bağ oluşumu sırasında çevreye verilen enerji ne kadar fazla ise oluşan molekül o kadar kararlıdır.
ÖRNEK:
oluşurken;
► (H-H) arasındaki bağı koparmak için 1 mol başına 104 k.kal enerji çevreden verilir.
► (Cl-Cl) arasındaki bağı koparmak için 1 mol başına 58 kkal enerji çevreden verilir.
► H-Cl bağı oluşurken çevreye mol başına 103 kkal enerji verilir. 2 mol HCl oluştuğuna göre verilen enerji 2.103 = 206 kkal’dir.
► Bu tepkime sırasında ve
molekülleri arasındaki bağları koparmak için toplam (1’er mol için)
104 + 58 = 162 k.kal çevreden verilir. (Moleküllerin aldığı enerji)
2 mol HC1 oluşmasında çevreye 206 k.kal’lik enerji verilir.
Çevreye verilen enerji = 206 k.kal
Çevreden alman enerji = -162 k.kal
Fark = 44 k.kal
Bu tepkimede 2 mol HC1 oluştuğunda çevreye 44 k.kal’lik enerji verilir.
1 mol HC1 için çevreye 22 k.kal’lik enerji verilir.
► Bu enerji 1 mol HCl(g) nın elementlerinden oluşumu sırasında çevreye verdiği enerjidir.
HCl için oluşma ısısıdır.
OLUŞMA ISISI:
1 mol bileşiğin elementlerinden oluşması için gereken enerji değişimidir.
ÖRNEK:
NO(g)’nın oluşma ısısının hesaplanması:
NO(g) oluşumu için tepkime denklemi;
şeklindedir.
‘nın bağ koparma enerjisi 225 k.kal,
‘nın bağ koparma enerjisi 118 k.kal dir.
Çevreden verilen toplam enerji 343 k.kal’dir.
2 mol NO gazının oluşması sırasında çevreye 299,8 k.kal’lik enerji verilir.
Aradaki fark: 343 – 299,8 = 43,2 k.kal’dir.
1 mol NO elementlerinden oluşurken çevreden 21,6 k.kal enerji alır.
TEPKİME ISISI: Bir tepkimede çevreden alman veya çevreye verilen ısıdır.
Q simgesi ile gösterilir.
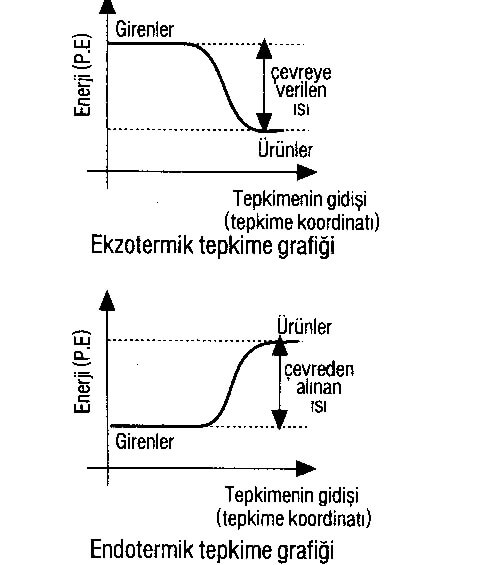
ENDOTERMİK ve EKZOTERMİK TEPKİMELER
► Çevreden ısı alan tepkimelere ENDOTERMİK tepkime, çevreye ısı veren tepkimelere EKZOTERMİK tepkime denir.
ÖRNEK:
NO(g), oluşumunda çevreden ısı aldığından endotermik tepkime, HCl(g), oluşumunda çevreye ısı verdiğinden ekzotermik tepkimedir.
ALINAN-VERİLEN ENERJİNİN TEPKİME DENKLEMİYLE GÖSTERİLMESİ
1)
► Endotermik tepkimelerde tepkime ısısı, denklemden bağımsız yazıldığında işareti pozitif (+) olur.
Q = + 43,2 kkal
2)
► Ekzotermik tepkimelerde tepkime ısısı, denklemden bağımsız yazıldığında işareti negatif (-) olur.
Q= -44 kkal
TEPKİME ENTALPİSİ
Isı soğurulması sonucu maddelerin yapısında depolanan enerjiye ENTALPİ (ISI KAPSAMI) denir. H ile gösterilir.
► Sabit basınç altındaki tepkime ısısı tepkime entalpi değişimine eşittir.
► Tepkime entalpisi; tepkime ürünlerinin oluşma entalpileri toplamından, girenlerin oluşma entalpileri toplamı çıkarılarak bulunur.
► 25°C, 1 atmosferde (standart hal) elementel haldeki maddelerin oluşma entalpileri sıfır (0) kabul edilir.
► MOLAR ENTALPİ: Mol başına düşen entalpidir.
YANMA ISISI (ENTALPİSİ):
1 mol maddenin ile tepkimesinde ki entalpi değişimidir.
ÖRNEK:
► 1 mol C’un tam yanması sonucu entalpi değişimi aynı zamanda ‘nin oluşma entalpisine eşittir.
TEPKİME ISILARININ TOPLANABİLİRLİĞİ
1) Bir tepkime denklemi iki veya daha çok tepkime denklemlerinin toplamı olarak yazılabiliyorsa; bu tepkimenin ısısı, toplanan denklemlerin tepkime ısılarının toplamına eşittir (Hess Yasası)
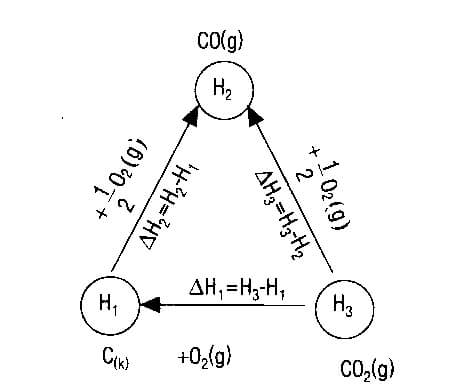
► Tepkime entalpisi; ilk ve son hale bağlıdır, izlenen yola bağlı değildir.
2) Tepkime denklemi zıt yönde yazılırsa (ters çevrilirse) tepkime entalpisinin işareti değişir.
► Maddenin farklı fiziksel hallerindeki entalpileri farklı olduğundan tepkime denklemlerinde türlerin halleri belirtilir.
► Kimyasal sistemlerde de enerji korunur.
ENERJİDE EN AZA, DÜZENSİZLİKTE EN ÇOĞA YÖNELMESİYLE olur.
katı → sıvı → gaz
hale geçişte enerji ve düzensizlik artar.
► Gaz fazındaki homojen tepkimelerde, mol sayısı çok olan taraf daha düzensizdir.
► Gaz, sıvıda çözündüğünde düzensizliği azalır.
► Katılar sıvıda çözündüğünde düzensizliği artar.
► Gaz fazındaki homojen