Halojenler nelerdir? Halojenlerin fiziksel, atomik ve kimyasal özellikleri nelerdir? Halojenlerin davranış biçimleri, periyodik tablodaki yeri.
Halojenler
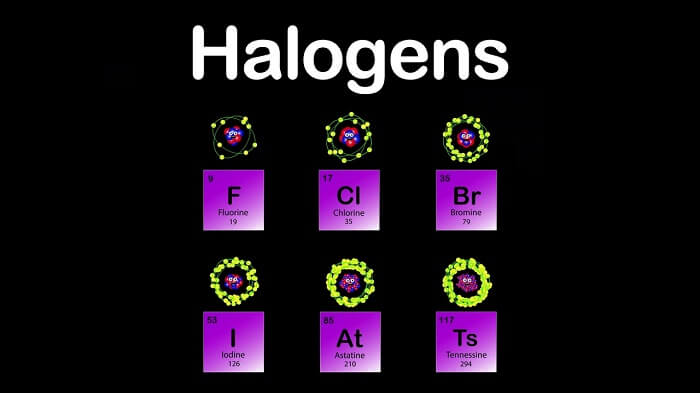
Halojenler; periyodik çizelgenin VII A grubunu oluşturan fluor (F), Klor (Cl), Brom (Br), İyot (I) ve Astatin (At), elementlerine verilen addır. Halojen adı Yunanca “tuz oluşturan” anlamına gelir. Bu nedenle Halojenler tuz ailesinin birer üyesidirler. Astatin dışında tümü ametaldir. Yine tümü benzer kimyasalözellik ve kimyasal davranış gösterirler. Metallerle doğrudan birleşerek tuz oluştururlar. Yalnız astatin grupta bulunduğu halde yarı metal olduğundan ve doğada çok az bulunduğundan kuvvetli bir radyoaktif elementtir. Çok aktif elementler olan halojenler, doğada serbest olarak bulunmazlar. Aktiflikleri fluordan başlayarak iyoda doğru azalır. Bileşiklerinden elde edilen verilere göre yerkabuğunun % 0.2’si klor, % 0.1’i fluor, % 0.001’i brom, % 0.001’i iyottur. Brom ve klor bileşikleri suda eridiklerinden büyük ölçüde deniz ve tuzlu göl sularında toplanmışlardır.
Atomik Özellikleri
Halojen ailesi periyodik tablodaki Grup 17’yi (Grup VII veya VIIA) işgal eder ve grup numarası değerlik elektronlarının sayısını belirtir. Halojenler, en dıştaki kabuklarında sekizli kuralını karşılamak ve böylece kararlı bileşikler oluşturmak için başka bir atomdan bir elektron alabilen yedi değerlik elektronuna sahiptir. Büyük reaktiviteleri nedeniyle, halojenler doğada serbest elementler olarak değil, daha çok diyatomik moleküller, örneğin ve
olarak bulunur.
Periyodik tablodaki satırlardan aşağıya inildiğinde, enerji seviyesi yükselir, ancak elektron konfigürasyonu en üst seviyede olmaz. Florun valans elektron konfigürasyonu , iyotun
‘tir. Çekirdeğin etrafındaki elektron katmanlarının sayısı da flordan klor, bromdan iyota yükselir. Sonuç olarak, atomik yarıçap artar çünkü elektron itilmesinden dolayı daha fazla katman daha fazla yer kaplar.
Elektronegatiflik, bir atomun elektronları kendine çekme yeteneğinin bir ölçüsüdür. Genellikle Pauling ölçeğinde ölçülür ve değerler deneysel olarak belirlenir. Florin halojenler arasında en yüksek 3.98 elektronegatifliğe sahiptir ve elektronegatiflik grupta azalır. İyonizasyon enerjisi, bir atomdan bir elektronun uzaklaştırılması için gereken enerji miktarıdır. Element ne kadar elektronegatif olursa, iyonlaşma enerjisi o kadar yüksek olur. Böylece, florin halojen ailesi boyunca en yüksek iyonlaşma enerjisine sahiptir.
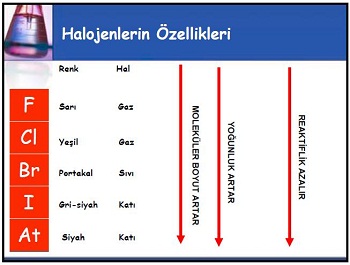
Fiziksel Özellikleri:
Standart sıcaklık (273.15 K veya 0 ° C) ve basınç (105 Pa veya 1 bar) koşullarında, flor ve klor gazlardır, bromin bir sıvıdır ve iyot katı olarak bulunur. Genel bir eğilim olarak, erime ve kaynama noktaları halojen grubunu aşağı doğru arttırır. Halojenler diatomik moleküller olarak bulunduğundan, van der Waals dispersiyon kuvvetleri moleküller arasındaki birincil moleküller arası kuvvetlerdir.
Bu kuvvetler daha büyük moleküllerde daha belirgindir, çünkü van der Waals kuvvetleri oluşturan geçici dipoller oluşturmak için çekirdeğin etrafında hareket eden daha fazla elektron vardır.
Flor, hidrojen florür, oksijen ve ozon oluşturmak için su ile şiddetli reaksiyona girer. Klor, soluk sarı bir çözelti elde etmek için suda hafifçe çözünür. Sulu brom çözeltisi, konsantrasyona bağlı olarak sarıdan kırmızımsı kahverengiye kadar bir dizi renk benimser. İyot çözeltisi soluk kahverengidir, ancak katı ve gazı kristal siyah ve menekşe renklidir.
Kimyasal Özellikleri:
Halojenler güçlü oksitleyici ajanlardır. Halojenler değerlik kabuklarında yedi elektrona sahip olduklarından, diğer moleküllerden elektron alma ve böylece oksitleme eğilimindedirler. Bu oksitleyici özellik halojen grubunu azaltır, flor en güçlü oksitleyici maddedir.
Oksitleyici özellik:
Örneğin, florin suyu oksijene okside edebilir ve aşağıdaki denklemlerde gösterildiği gibi bileşiklerinden herhangi bir halid iyonunu değiştirme yeteneğine sahiptir. Bununla birlikte, klor sadece bromür, iyodür ve astatid iyonlarından ve sadece brom iyodür ve astatid iyonlarından elektron alma yeteneğine sahiptir.
Halid iyonları için florür iyonu, indirgeme özelliği göstermezken, iyodür iyonu, hafif bir indirgeyici maddedir. Yetenekleri azaltma eğilimi florürden iyodite yükselir. Bu, iyodürün, sülfürik asidi üç aşamada azalttığı konsantre sülfürik asit ile reaksiyonunda gösterilmiştir.
Sülfür oksidasyon durumu: +6 → +4 → 0 → -2
Sülfürün oksidasyon durumu, sülfürik asit içinde +6’dan hidrojen sülfürde -2’ye düşürülür. Bu reaksiyon ekzotermiktir ve başlıca ürünler olarak iyot (mor buhar) ve hidrojen sülfür (“çürük yumurta” kokusu) verir.
Halojenler ayrıca hidrojen halojenürler olarak hidrojen ile bileşikler oluşturur. Hidrojen-halojen bağı florürden iyodite düşer ve hidrojen halojenür molekülleri birbirleriyle zikzak şeklinde hidrojen bağları oluşturur. Karşılık gelen asidin asitliği, hidrojen halojenürler suda çözündüğünde, hidroflorik asitten hidroiyodik aside yükselir. Hidrobromik ve hidroiyodik asit güçlü asitlerdir. Hidroflorik asit sadece zayıf bir asit olmasına rağmen, mukavemet olarak formik asit gibi organik asitlere benzer.