Helyum elementinin özellikleri, atom numarası, bileşikleri, tarihçesi, periyodik cetveldeki yeri, kullanım alanları, Helyum elementi ile ilgili bilgi.
Helyum
Helyum soy gazlardan (asal gaz) biridir. Helyum gazı monoatomik, reaktif, renksiz ve kokusuz bir gazdır. Helyum, basınçlı tanklarda kullanılabilir. Helyum, evrende hidrojenden sonra ikinci en bol bulunan elementtir.
Helyum hidrojene göre daha ağır bir element olsa da çok daha güvenli olduğundan hava balonlarında kullanılır. Zehirsiz bir gazdır. Helyum soluduktan sonra konuşmaya çalışan bir insanın sesi gıcırtılı çıkar. (Denemeyin)
Sembolü: He
Atom Numarası: 2
Atom Ağırlığı: 4,002602(2) g·mol−1 g/mol
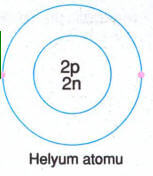
Elektron Sayısı: 2
Elemet serisi: Asal Gaz
Periyodik Tablodaki Yeri: 8A
Maddenin Hali: Gaz
Görünümü: Renksiz
Helyum yer kabuğunun milyarda 3 kadarını oluşturur. Ayrıca atmosferde serbest olarak da bulunur. Sıcak yıldızlar büyük ölçüde helyum içerir. 3 tane kararlı izotopu vardır.
Sıvılaştıktan sonra normal basınç altında sıcaklık ne kadar düşürülürse sıvı olarak kalır. Kaynayan helyumun buharı da çok yoğundur. Helyum’u 1868’de J. Jansen güneş tutulması sırasında güneş tayfını incelerken saptadı. Güneşte gözlemlendiğinde Yunanca güneş anlamına gelen Helios’tan adını aldı. 1895’de birbirinden bağımsız olarak helyumun uranyum filizinde de bulunduğunu saptadı. 1907’de Rutherford ve Royds radyoaktif bozunma sırasında yayılan alfa taneciklerinin helyum olduğunu kanıtladılar. Hidrojen bombasının enerjisini sağlayan da helyum atomlarının kaynaşmasıyla helyum haline dönüşmesinin tepkimesidir.
Helyumun Elde Edilmesi:
Helyum atmosferde çok bulunmasına rağmen pahalıdır. Çünkü elde edilmesi zordur. Sıvı havanın ayrımsal damıtılmasıyla elde edilemez. Bunun sebebi, Helyumun atmosferdeki diğer bir çok gazın aksine Joul-Thompson katsayısının pozitif olmayışıdır. Bu da onun sıkıştırılmak suretiyle sıvılaştırılmasını engeller ve de havadan elde edilmesini imkansız hale getirir. Amerikadaki (ABD) bazı doğal gaz yataklarında %7’ye varan oranlarda He gazı bulunmaktadır ki bu Helyumun ticari olarak satılabilecek kadar üretilmesine imkan sağlamaktadır.

Helyum ile doldurulmuş balonlar
Kullanım Alanları
Helyum gazı, balonları, bilimsel balonları ve parti balonlarını şişirmek için kullanılır. Ark kaynağı için, sıvı yakıtlı roketlerin yakıt depolarını ve süpersonik rüzgar tünellerinde basınç oluşturmak için inert bir kalkan olarak kullanılır. Helyum, derin deniz dalgıçları için azot içermeyen bir atmosfer yaratmak için oksijen ile birleştirilir, böylece azot narkozu olarak bilinen bir durumdan muzdarip olmazlar. Sıvı helyum önemli bir kriyojenik malzemedir ve süperiletkenliği incelemek ve süperiletken mıknatıslar oluşturmak için kullanılır.
Keşfedilmesi Tarihçesi
Evrendeki en bol ikinci element olan helyum, yeryüzünde bulunmadan önce güneşte keşfedildi. Fransız bir gökbilimci Pierre-Jules-César Janssen, 1868’de toplam güneş tutulması üzerinde çalışırken güneş spektrumunda sarı bir çizgi fark etti. İngiliz bir gökbilimci olan Sir Norman Lockyer, 587.49 nanometre dalga boyuna sahip bu çizginin, o zaman bilinen herhangi bir element tarafından üretilmediğini düşündü. Bu gizemli sarı emisyondan güneşte yeni bir elementin sorumlu olduğu varsayıldı. Bu elemente Lockyer tarafından helyum adı verildi. Yeryüzünde helyum bulma avı 1895’te sona erdi. İskoç kimyager Sir William Ramsay, levyum içeren mineral içeren uranyum ile bir deney yaptı. Kotititi mineral asitlere maruz bıraktı ve üretilen gazları topladı. Daha sonra bu gazların bir örneğini, içindeki helyumu tanımlayabilen Lockyer ve Sir William Crookes’e iki bilim adamına gönderdi. İki İsveçli kimyager, Nils Langlet ve Per Theodor Cleve, Ramsay ile yaklaşık olarak aynı zamanda slevitte helyum buldular.
Helyum, dünya atmosferinin yaklaşık % 0.0005’ini oluşturur. Bu eser miktarda helyum yerçekimiyle yeryüzüne bağlı değildir ve sürekli uzaya kaybolur. Dünyanın atmosferik helyumu, yer kabuğundaki radyoaktif elementlerin bozulmasıyla değiştirilir. Bir tür radyoaktif bozunma olan alfa bozunması, alfa parçacıkları adı verilen parçacıklar üretir. Bir alfa parçacığı, çevresinden iki elektron yakaladıktan sonra helyum atomu haline gelebilir. Bu yeni oluşan helyum en sonunda kabuktaki çatlaklardan atmosfere doğru yol alabilir.
42 yorum
orada 1895 de deil 1985 te olması gerek
helyumun kac atamu vardır
helyum nelerden oluşur
elektron sayısı nedir
süper
bravo çooooooooooook güzel bir site çooooooooooooooooooooooooooook beğendim
çooooooooooooooooooooooooooooook güzel bir site
elementler hakkında soru da yazarsanız sevinirim.
ödevim için süper tam aradığım gibi
güzelmiş evet 🙂
çok güzel bi site ama elektron sayısı ne demek
bilen anlatabilir mi
Elektron ve nötron sayısı 2 dır arkadaşlar
Saolun çok işime yaradı 😉 🙂 :-* :O :-\ 😀 =-O
eewt yha çok güzel miş tbrk ediomm 🙂 sizi sewiom 🙂
Çooooooook güzelmişşşş
çok işime yaradı sağolun süper bir site
çok işime yaradı çok sağolun süper bir site
Guzell
Bence güzel bir site çoook güzel açıklaması yapılmış
helyum elementi değerlığı
nedır
Helyum kararlı bir tondur deger ligi yoktur yani atom yükü
çok güzel bi site süpermiş çok işime yaradı
Çok işime yaradı ama bazı elementlerin kullanım alanları yok. Onlarda verilse çok süper bir site olacak.
çok güzel hazırlamışşınız teşekkürler yalnız kullanım alanlarınıda yazsaydınız daha iyi olurdu
ama yinede elinize sağlık… 🙂
bu siteyi yapanın ellerine sağlık bunun dewamını bekiliyorum zararları yarrarları mesala bunlar olsa iyi olurdu elinize sağlık
Nermin Akar
çokgüzel olmuş ama resim olsaydı daha güzel olar
(kas. Arpaçay)lıyım.
Arpaçaylılara slm
iyiymiş
Çok güzel bir site çok beğendim
Guzellllllll
Bilgiyi paylasanlardan Allah razi olsun.
iyi bir siteymiş
Çok guzel bir sayfa bütün odevlerimde bana yardımcı oldu
Mükemmel bir sayfa
Bencede
Çokk iyi ….
çok sağolun çok yardımcı oldu.??
çok iyi bir site çok yardımcı oldu sağolun ???
Sağolun…
fen projesinde çok yardımcı oldu şahane bir sayfa.
İşe yarar bilgiler var
Güzel yaa ben artık burdan bakçam