İyonik bileşiklerin formülleri nasıl yazılır? İyonik bileşiklerin adlandırılması ve formüllerinin yazılmasının adım adım örnekleri
İyonik bileşikler molekül olarak mevcut değildir. Katı halde, iyonik bileşikler, her biri katyon ve anyonun birçok iyonunu içeren kristal kafes içindedir. NaCl gibi iyonik bir formül, ampirik bir formüldür. Bu formül sadece sodyum klorürün eşit sayıda sodyum ve klorür iyonundan yapıldığını gösterir. Başka bir iyonik bileşik olan sodyum sülfit, formülüne sahiptir. Bu formül, bu bileşiğin sülfür iyonlarının iki katı kadar sodyum iyonundan oluştuğunu gösterir. Bu yazı size doğru bir formül yazabilmeniz için doğru iyon oranını nasıl bulacağınızı öğretecektir.
İkili iyonik bir bileşiğin adını biliyorsanız, kimyasal formülünü yazabilirsiniz. Metal iyonu yüküyle, ardından ametal iyonu yüküyle yazarak başlayın. Genel bileşiğin elektriksel olarak nötr olması gerektiğinden, pozitif ve negatif yükün birbirini iptal etmesi için her iyondan kaçına ihtiyaç olduğuna karar verin.
Örnek: Alüminyum Nitrür ve Lityum Oksit
Alüminyum nitrür ve lityum oksit formülünü yazın.
Çözüm
1. Önce katyonun (metal) sembolünü ve yükünü ve ikinci olarak anyonun (metal olmayan) yükünü yazın.
alüminyum nitrür – ve
2. Katyonların ve anyonların toplam yükünü birbirine eşit hale getirmek için bir çarpan kullanın.
toplam katyon yükü = toplam anyon yükü
1 (3+) = 1 (3-)
+3 = -3
3. Çarpanları her iyon için alt simge olarak kullanın.
4. Son formülü yazın. Tüm yükleri ve 1 olan tüm alt simgeleri dışarıda bırakın.
AlN
Aynı İşlemleri lityum oksit için de uygulayalım;
ve
toplam katyon yükü = toplam anyon yükü
2 (1+) = 1 (2-)
+2 = -2
Çaprazlama Yöntemi
İyonik bir bileşik için doğru bir formül yazmanın alternatif bir yolu çaprazlama yöntemini kullanmaktır. Bu yöntemde, her bir iyon yükünün sayısal değeri çaprazlanır ve diğer iyonun alt simgesi haline gelir.
Örnek: Kurşun (IV) oksit için Çapraz Yöntemi
Kurşun (IV) oksit için formülü yazınız.
Çözüm:
1. Önce katyonun (metal) sembolünü ve yükünü ve ikinci olarak anyonun (metal olmayan) yükünü yazın.
ve
2. Anyonun alt simge olması için yalnızca pozitif yükün sayısını ve katyonun alt simge olması için yalnızca eksi yükün sayısını aktarın.
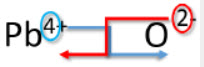
3. En düşük orana düşürün.
4. Son formülü yazın. 1 olan tüm alt simgeleri dışarıda bırakın.
İyonik bileşiklerin ampirik formüller olduğunu ve bu nedenle iyonların en düşük oranı olarak yazılması gerektiğini unutmayın.
Poliatomik iyonlar
Bazı iyonlar, birbirine bağlanmış atom gruplarından oluşur ve genel bir elektrik yüküne sahiptir. Bu iyonlar birden fazla atom içerdiği için çok atomlu iyon olarak adlandırılır. Çok atomlu iyonların ezberlenmesi gereken karakteristik formülleri, adları ve yükleri vardır. Örneğin , nitrat iyonudur; bir nitrojen atomu ve üç oksijen atomu ve toplam 1− yüke sahiptir.
Bazı Poliatomik İyonlar
- amonyum iyonu
- asetat iyonu
(ayrıca
şeklinde yazılır)
- karbonat iyonu
- kromat iyonu
- dikromat iyonu
- hidrojen karbonat iyonu (bikarbonat iyonu)
- siyanür iyonu
- hidroksit iyonu
- nitrat iyonu
- nitrit iyonu
- permanganat iyonu
- fosfat iyonu
- hidrojen fosfat iyonu
- dihidrojen fosfat iyonu
- sülfat iyonu
- hidrojen sülfat iyonu (bisülfat iyonu)
- sülfit iyonu
Çok atomlu iyonlar içeren iyonik bileşikler için formül oluşturma kuralı, tek atomlu iyonları içeren formüllerle aynıdır: pozitif ve negatif yükler dengelenmelidir. Yükü dengelemek için belirli bir çok atomlu iyondan birden fazlasına ihtiyaç duyulursa, çok atomlu iyonun formülünün tamamı parantez içine alınmalı ve sayısal alt simge parantezlerin dışına yerleştirilmelidir. Bu, alt simgenin tüm çok atomlu iyon için geçerli olduğunu göstermek içindir. Bir örnek ‘dir.
Poliatomik İyon İçeren İyonik Bileşikler İçin Formüller Yazma
Çok atomlu iyonlar içeren iyonik bileşikler için bir formül yazmak da ikili iyonik bileşik için olanla aynı adımları içerir. Katyonun sembolünü ve yükünü, ardından anyonun sembolünü ve yükünü yazın.
Örnek: Kalsiyum Nitrat
Kalsiyum nitrat formülünü yazın.
Çözüm
1. Önce katyonun (metal) sembolünü ve yükünü ve ikinci olarak anyonun (metal olmayan) yükünü yazın.
ve
2. Anyonun alt simge olması için yalnızca pozitif yükün sayısını ve katyonun alt simge olması için yalnızca eksi yükün sayısını aktarın.

3. En düşük orana düşürün.
4. Son formülü yazın. 1 olan tüm alt simgeleri dışarıda bırakın. Çok atomlu iyonlardan yalnızca 1 tanesi varsa, parantezleri bırakın.
İyonik Bileşikleri Tanıma
İyonik bileşikleri tanımanın iki yolu vardır. İlk olarak, metal ve ametal olmayan elementler arasındaki bileşikler genellikle iyoniktir. Örneğin, bir metalik element (kalsiyum, bir grup 2 (veya 2A) metal) ve bir metal olmayan element (brom, bir grup 17 (veya 7A) ametal) içerir. Bu nedenle, büyük olasılıkla iyonik bir bileşiktir. (Aslında, iyoniktir.) Bunun aksine,
bileşiği, hem ametal olmayan (grup 15 (veya 5A) nitrojen ve grup 16 (veya 6A) ‘dan oksijen olan iki element içerir. İyonik bir bileşik değildir. bu, kovalent bileşikler kategorisine aittir. Ayrıca, bu nitrojen ve oksijen kombinasyonunun, belirtilen elektrik yüküne sahip olmadığını, dolayısıyla nitrit iyonu olmadığını unutmayın.
İkincisi, bir bileşikteki çok atomlu bir iyonun formülünü tanırsanız, bileşik iyoniktir. Örneğin, formülünü görürseniz, “
” kısmını nitrat iyonu
olarak tanıyabilirsiniz. (İyonik bileşikler için formül yazma kuralının iyonik yükü içermediğini unutmayın.) Bu, formülün diğer kısmı olan Ba’nın aslında
iyonu olduğuna ve 2+ yükün toplam 2−’yi dengelediğine dair bir ipucudur. Dolayısıyla bu bileşik de iyoniktir.