İyonik ve kovalent bağlı bileşiklerin yapıları ve özellikleri nasıldır? İyonik, kovalent ve matlik bağlı bileşiklere, yapılara örnekler.
İyonik bağ iyonları dev bir kafes içinde bir arada tutar. Kovalent bağlar basit moleküller veya dev kovalent yapılar oluşturur. Farklı bağlanma türleri bir maddeye farklı özellikler verir – farklı erime ve kaynama noktaları, farklı elektriksel iletkenlik ve suda daha fazla çözünürlük.
İyonik bileşikler
Dev bir iyonik kafes, iyonik bağlanma ile bir arada tutulan zıt yüklü iyonların üç boyutlu bir yapısıdır.
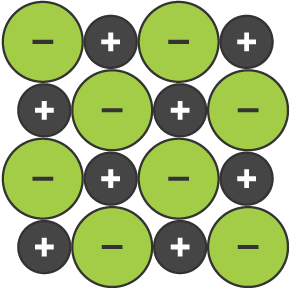
Sodyum klorürün iyonik kafes içinde bir iyon tabakası.
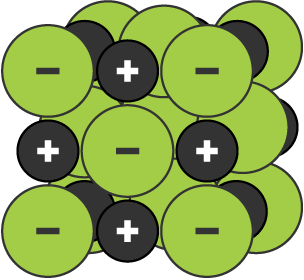
Sodyum klorür için iyonik kafes
İyonik bileşiklerin fiziksel özellikleri
- Yüksek erime ve kaynama noktaları. İyonik katılar yüksek bir erime noktasına ve kaynama noktasına sahiptir, çünkü iyonları bir arada tutan güçlü iyonik bağın kırılması önemli miktarda enerji gerektirir.
- Elektiriksel iletkenlik. İyonik bileşikler, erimiş veya suda eritildiğinde elektrik iletirler çünkü iyonlar hareket edebilir ve yük taşıyabilir.
- Suda çözünürlük. Çoğu iyonik bileşik suda çözünür ve sulu çözeltiler oluşturur.
Kovalent yapılar
Kovalent bağ, iki tip yapıya sahip maddeler oluşturur:
- Moleküler kovalent yapılar. Zayıf çekim kuvvetleri tarafından bir arada tutulan basit moleküllerdir. Örnekler arasında iyot, metan ve karbon dioksit bulunur.
- Dev kovalent yapılar. Birçok atom, güçlü kovalent bağlarla birleşti. Örnekler elmas ve grafittir.
Moleküler kovalent yapılar
Moleküler kovalent moleküllerdeki atomlar, güçlü kovalent bağlarla bir arada tutulur. Bu bağlar güçlü olmasına rağmen, moleküller arasında sadece zayıf çekim kuvvetleri vardır. Bu zayıf çekici güçlere van der Waals’ın kuvvetleri denir ve çok az enerji ile kırılabilirler.
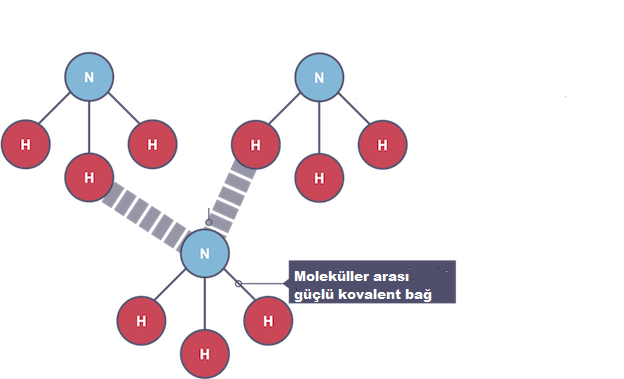
Moleküler kovalent yapıların fiziksel özellikleri
- Düşük erime ve kaynama noktaları. Zayıf van der Waals’ın moleküller arasındaki kuvvetlerini kırmak için çok az enerji gerekir, bu nedenle kovalent moleküler yapılar düşük erime ve kaynama noktalarına sahiptir.
- Elektrik iletmez. Kovalent moleküler yapılar elektriği iletmez, çünkü moleküller nötrdür ve yükü taşımak ve iletmek için yüklü parçacıklar (iyon veya elektron yok) yoktur.
- Suda çözünmez. Kovalent bileşiklerin çoğu suda çözünmez. Hidrojen klorür ve amonyak istisnadır, çünkü su ile reaksiyona girerler.
Dev kovalent yapılar
Dev bir kovalent yapı, kovalent bağlarla birleştirilen atomların üç boyutlu bir yapısıdır.
Allotroplar aynı elementin aynı durumda farklı formlarıdır.
Grafit, grafen ve elmas, aynı elementin (karbon) aynı durumda (katı) allotroplarıdır. Karbon dört adede kadar kovalent bağ oluşturabilir.
Elmas
Elmas, her karbon atomunun dört yüzlü, üç boyutlu bir yapıda diğer dört karbon atomuna kovalent olarak bağlandığı dev bir kovalent yapıdır. elmasın özellikleri şunları içerir:
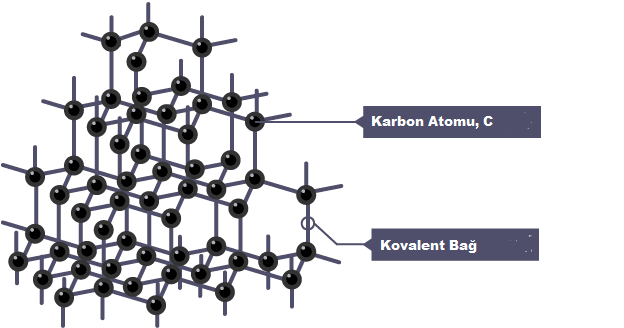
- Yüksek erime ve kaynama noktaları. Elmasın birçok kovalent bağı güçlüdür ve onları kırmak için önemli miktarda enerjiye ihtiyaç vardır.
- Elektrik iletmez. Elmasın yükü taşımak ve taşımak için serbest iyonları veya delokalize elektronları yoktur.
- Sertlik. Elmasın güçlü kovalent bağlara sahip üç boyutlu tetrahedral yapısı onu çok zorlaştırıyor.
Grafit
Grafit, içinde dev bir kovalent yapıya sahiptir:
- Her karbon atomu diğer karbon atomları ile üç kovalent bağ oluşturur
- Karbon atomları altıgen halkaların katmanlarını oluşturur.
- Katmanlar arasında zayıf çekim kuvvetleri vardır.
- Her atom için bir, bağlanmamış – veya delokalize edilmemiş – elektron vardır.
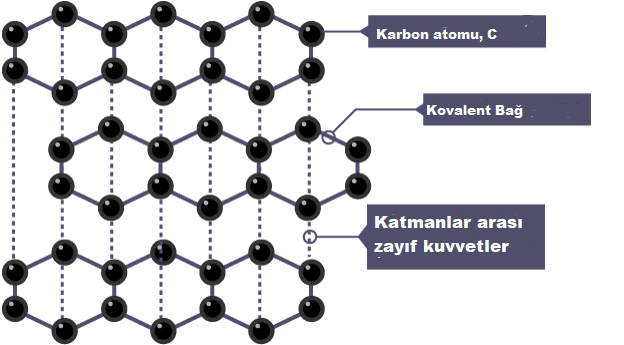
Grafitin özellikleri şunları içerir:
- Yüksek erime ve kaynama noktaları. Grafitin birçok kovalent bağı güçlüdür ve bunları kırmak için önemli miktarda enerjiye ihtiyaç vardır.
- İyi elektriksel iletkenlik. Her karbon atomunun bağlanmamış bir elektronu vardır. Bağlı olmayan elektronlar, hareket edebilen ve yükü taşıyabilen delokalize elektronlardır.
- Yumuşaklık. Grafitin katmanları arasındaki zayıf kuvvetler kaymalarına izin verir.
Metalik yapılar
Metaller, düzenli katmanlar halinde düzenlenmiş pozitif iyonların dev kafesleridir, delokalize elektronlar yapı boyunca hareket etmekte serbesttir. Özellikleri şunları içerir:
- Yüksek erime ve kaynama noktaları. Güçlü metalik bağları kırmak için yüksek sıcaklıklar gereklidir.
- İyi elektriksel iletkenlik. Metalin delokalize elektronları hareket edebilir ve yük taşıyabilir.
- Dövülebilir ve sünek. Metalin iyon katmanları birbiri üzerinde kayabilir, ancak yerelleştirilmemiş elektronlar tarafından hala bir arada tutulur. Bu, metalin dövülebilir (şekil verilebilmesi) ve sünek (tellere çekilebilmesi) anlamına gelir.
Alaşımlar
Bir alaşım, en az biri metal olan iki veya daha fazla elementin bir karışımıdır. Karışım metalik özelliklere sahiptir.
Alaşımlar metalik yapılara sahiptir, ancak farklı elementlerin farklı boyutlu atomları bu yapıyı bozar. Bu, katmanların üst üste kaymasını zorlaştırır. Bu nedenle alaşımlar saf metallerden daha serttir.
Altın
Mücevherat için kullanılan altın, genellikle gümüş, bakır veya çinko gibi diğer metallerle alaşımlıdır. Bu mücevheri parlaklığını korurken güçlendirir.
Alaşımdaki altın oranı karatlarla ölçülür. 24 ayar altın saf altın, 18 ayar altın % 75 saf altındır.