İzotop atom nedir? İzotop atom nasıl oluşur, kimyasal özellikleri aynı mıdır, nedenleri, örnek sorular ve çözümleri.
Aynı elementin tüm atomları aynı sayıda protona sahiptir, ancak bazılarında farklı sayıda nötron bulunabilir. Örneğin, tüm karbon atomlarının altı protonu vardır ve çoğunun da altı nötron vardır. Ancak bazı karbon atomlarının normal altı yerine yedi veya sekiz nötron vardır. Nötron sayılarında farklılık gösteren aynı elementin atomlarına izotop denir. Birçok izotop doğal olarak oluşur. Genellikle bir elementin bir veya iki izotopu en kararlı ve yaygın olanlardır. Bir elementin farklı izotopları genellikle aynı fiziksel ve kimyasal özelliklere sahiptir. Bunun nedeni, aynı sayıda proton ve elektrona sahip olmalarıdır.
Özet
- Aynı elementin atomlarında proton sayısı her zaman aynıdır.
- Nötron sayısı, aynı elementin atomlarında bile farklı olabilir.
- Aynı elementin aynı sayıda proton içeren, ancak farklı sayıda nötron içeren atomları izotop olarak bilinir.
- Herhangi bir elementin izotoplarının tümü aynı sayıda proton içerir, bu nedenle aynı atom numarasına sahiptirler (örneğin, helyumun atom numarası her zaman 2’dir).
- Belirli bir elementin izotopları farklı sayıda nötron içerir, bu nedenle farklı izotoplar farklı kütle numaralarına sahiptir.
Bir Örnek: Hidrojen İzotopları
Hidrojen, izotopları olan bir element örneğidir. Üç hidrojen izotopu, aşağıda modellenmiştir. Çoğu hidrojen atomu sadece bir proton ve bir elektrona sahiptir ve bir nötron içermez. Bu atomlara sadece hidrojen denir. Bazı hidrojen atomlarının da bir nötron vardır. Bu atomlar döteryum adlı izotoptur. Diğer hidrojen atomlarının iki nötron vardır. Bu atomlar trityum adlı izotoplardır.
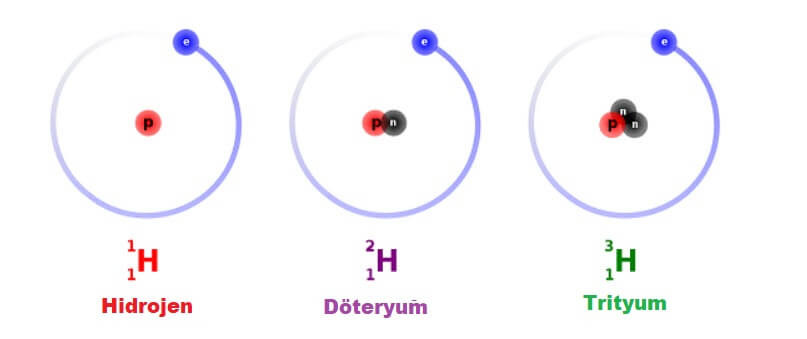
Hidrojen dışındaki çoğu element için, izotoplar kütle numaralarına göre adlandırılır. Örneğin, normal 6 nötronlu karbon atomlarının kütle sayısı 12’dir (6 proton + 6 nötron = 12), bu nedenle bunlara karbon-12 denir. 7 nötronlu karbon atomlarının atomik kütlesi 13’tür (6 proton + 7 nötron = 13). Bu atomlar, karbon-13 adı verilen izotoptur.
Örnek Lityumun İzotopları
a. 3 nötron içeren bir lityum izotopunun atom numarası ve kütle numarası nedir?
b. 4 nötron içeren bir lityum izotopunun atom numarası ve kütle numarası nedir?
Çözüm
Bir lityum atomu, nötron veya elektron sayısına bakılmaksızın çekirdeğinde 3 proton içerir.
a. atom numarası = (proton sayısı) (nötron sayısı) = 3 = 3
kütle numarası kütle numarası = (proton sayısı) + (nötron sayısı) = 3 + 3 = 6
b. atom numarası = (proton sayısı) (nötron sayısı) = 3 = 4
kütle numarası kütle numarası = (proton sayısı) + (nötron sayısı) = 3 + 4 = 7
Lityum atomunda her zaman 3 protona sahip olduğu için, lityum için atom numarası her zaman 3’tür. Bununla birlikte, kütle numarası 3 nötronlu izotopta 6 ve 4 nötronlu izotopta 7’dir. Doğada yalnızca belirli izotoplar vardır. Örneğin lityum, 3 nötronlu bir izotop ve 4 nötronlu bir izotop olarak bulunur, ancak 2 nötronlu bir izotop veya 5 nötronlu bir izotop olarak mevcut değildir.
İzotopların Kararlılığı
Atomların kararlı bir çekirdeğe sahip olması için belirli bir nötron / proton oranına ihtiyacı vardır. Protonlara göre çok fazla veya çok az nötron olması, er ya da geç daha kararlı bir forma dönüşecek olan kararsız ya da radyoaktif bir çekirdekle sonuçlanır. Bu sürece radyoaktif bozunma adı verilir. Birçok izotopun radyoaktif çekirdeği vardır ve bu izotoplara radyoizotoplar denir. Bozulduklarında, zararlı olabilecek parçacıkları serbest bırakırlar. Bu nedenle radyoaktif izotoplar tehlikelidir ve onlarla çalışmak koruma için özel giysiler gerektirir. Karbon-14 olarak bilinen karbon izotopu, bir radyoizotop örneğidir. Buna karşılık, karbon-12 ve karbon-13 adı verilen karbon izotopları kararlıdır.
İzotoplarla ilgili tüm bu tartışma bizi Dalton’un Atom Teorisine geri getiriyor. Dalton’a göre, belirli bir elementin atomları aynıdır. Fakat belirli bir elementin atomları farklı sayıda nötron içerebiliyorsa, o zaman farklı kütlelere de sahip olabilirler! Dalton bunu nasıl kaçırdı? Doğada bulunan elementlerin, doğal olarak oluşan izotoplarının sabit tekdüze karışımları olarak var olduğu ortaya çıktı. Başka bir deyişle, bir parça lityum her zaman doğal olarak oluşan lityumun her iki türünü de içerir (3 nötronlu tip ve 4 nötronlu tip). Dahası, ikisini her zaman aynı nispi miktarlarda (veya “nispi bolluklarda”) içerir. Bir lityum yığınında, % 93’ü her zaman 4 nötronlu lityum olurken, kalan % 7’si her zaman 3 nötronlu lityum olacaktır.
Dalton Ne Yaptı?
Dalton her zaman bir elementin büyük parçalarını denedi – o elementin doğal olarak oluşan tüm izotoplarını içeren yığınlar. Sonuç olarak, ölçümlerini gerçekleştirdiğinde, aslında numunedeki tüm farklı izotopların ortalama özelliklerini gözlemliyordu. Kimyadaki amaçlarımızın çoğu için, aynı şeyi yapacağız ve atomların ortalama kütlesiyle ilgileneceğiz. Neyse ki, farklı kütlelere sahip olmanın yanı sıra, farklı izotopların diğer özelliklerinin çoğu benzerdir.
Bilim adamlarının ilgilendikleri bir atomun kütle numarasını sıklıkla göstermesinin iki ana yolu vardır. Kütle numarasının periyodik tabloda verilmediğine dikkat etmek önemlidir. Bu iki yol, bir nükleer sembol yazmayı veya elementin adını yazılı kütle numarasıyla vermeyi içerir.
Bir nükleer sembol yazmak için, kütle numarası kimyasal sembolün sol üst (üst simge) kısmına ve atom numarası sembolün sol alt köşesine (alt simge) yerleştirilir. Helyum-4 için tam nükleer sembol aşağıda çizilmiştir:
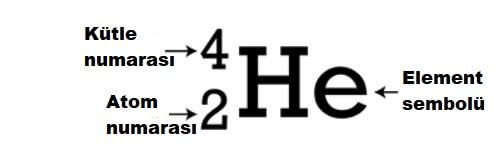
İzotopları temsil etmenin başka bir yolu, kimyasal ada veya sembole bir tire ve kütle numarası eklemektir. Böylece, iki çekirdek Nikel-59 veya Ni-59 ve Uranyum-238 veya U-238 olacaktır; burada 59 ve 238, sırasıyla iki atomun kütle numaralarıdır. Kütle numaralarının (nötronların sayısının değil) ismin yanında verildiğine dikkat edin.
Örnek: POTASYUM-40
‘lik bir atomda kaç proton, elektron ve nötron vardır?
Çözüm
atom numarası = (proton sayısı) = 19 (4.8.3)
Yüksüz tüm atomlar için elektron sayısı proton sayısına eşittir.
elektron sayısı = 19 (4.8.4)
Kütle sayısı 40, protonların ve nötronların toplamıdır.
Nötron sayısını bulmak için kütle numarasından proton sayısını çıkarın.
nötron sayısı = 40−19 = 21. (4.8.5)
Örnek: Zinc-65
Bir çinko-65 atomunda kaç proton, elektron ve nötron vardır?
Çözüm
proton sayısı = 30 (4.8.6)
Yüksüz tüm atomlar için elektron sayısı proton sayısına eşittir.
elektron sayısı = 30 (4.8.7)
Kütle sayısı 65, protonların ve nötronların toplamıdır.
Nötron sayısını bulmak için kütle numarasından proton sayısını çıkarın.
nötron sayısı = 65−30 = 35