Kimyada Stokiyometri Nedir? Stokiyometrinin tanımı özellikleri, kimyada karşılaşabileceğimiz Stokiyometri problemleri hakkında bilgi.
Kimyada Stokiyometri Nedir?
Stokiyometri, genel kimyadaki en önemli konulardan biridir. Tipik olarak atomun bölümleri ve birim dönüşümleri tartışıldıktan sonra tanıtılır. Zor olmasa da, birçok öğrenci karmaşık sözcüklerden uzak durur. Bu nedenle “Kitle İlişkileri” olarak tanıtılabilir.
Stokiyometri Tanımı
Stokiyometri, fiziksel bir değişim veya kimyasal değişim (kimyasal reaksiyon) geçiren iki veya daha fazla madde arasındaki nicel ilişkilerin veya oranların incelenmesidir. Kelime Yunanca kelimelerden türetilmiştir: stoicheion (“element” anlamına gelir) ve metron (“ölçmek” anlamına gelir). En sık olarak, stokiyometri hesaplamaları, ürün ve reaktiflerin kütlesi ya da hacimleriyle ilgilidir.
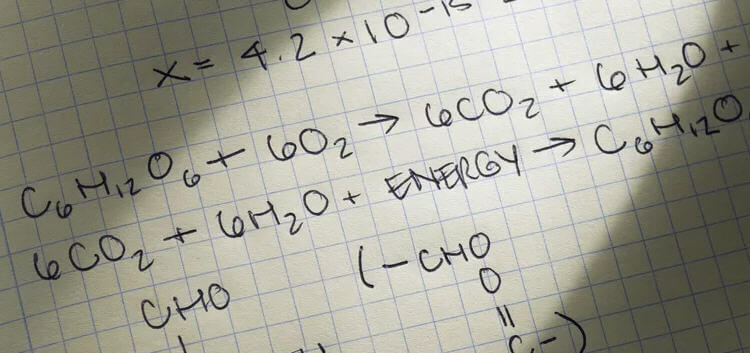
Stokiyometri Nedir?
Jeremias Benjaim Richter, 1792 yılında stokiyometriyi, kimyasal elementlerin miktarlarını veya kütle oranlarını ölçme bilimi olarak tanımladı. Kimyasal bir denklem ve bir reaktan veya ürünün kütlesi verilebilir ve denklemdeki başka bir reaktan veya ürünün miktarını belirlemeniz istenebilir. Veya, reaktanların ve ürünlerin miktarları size verilebilir ve matematiğe uygun olan denklemi yazmanız istenebilir.
Stokiyometride Önemli Kavramlar
Stokiyometri problemlerini çözmek için aşağıdaki kimya kavramlarında uzmanlaşmalısınız:
***dengeleme denklemleri
***gram ve mol arasında dönüştürme
***mol kütlesi hesaplanması
***mol oranlarının hesaplanması
Unutmayın, stokiyometri, kitle ilişkilerinin incelenmesidir. Birim dönüşümleri ve dengeleme denklemleri konusunda rahat olmanız gerekir.
Kütle-Kütle Stokiyometrisi Problemi
Çözmek için stokiyometriyi kullanacağınız en yaygın kimya problemlerinden biri kütle-kütle problemidir. Kütle-kütle problemini çözme adımları şunlardır:
***Problemi doğru olarak tanımlayın. Genellikle, aşağıdaki gibi kimyasal bir denklem verilir:
A + 2B → C
Çoğu zaman, soru şu şekildedir: 10.0 gram A’nın B ile tamamen reaksiyona girdiğini varsayın. Kaç gram C üretilecek?
Kimyasal denklemi dengeleyin. Denklemdeki okun her iki tarafında, hem reaktanlar hem de ürün tarafındaki her bir atom türünün aynı sayıda olduğundan emin olun. Başka bir deyişle, Kütlenin Korunması Kanunu’nu uygulayın.
Problemdeki herhangi bir kütle değerini mol’e dönüştürün. Bunu yapmak için molar kütleyi kullanın.
Bilinmeyen mol miktarlarını belirlemek için molar oranını kullanın. Birbirine eşit olan iki molar oranını ayarlayın.
Bu maddenin mol kütlesini kullanarak, az önce bulduğunuz mol değerini kütleye dönüştürün.
Fazla Reaktan, Sınırlayıcı Reaktan ve Teorik Verim
Atomlar, moleküller ve iyonlar mol oranlarına göre birbirleriyle reaksiyona girdiklerinden, sizden sınırlayıcı reaktanı veya fazla miktarda mevcut herhangi bir reaktanı tanımlamanızı isteyen stokiyometri problemleriyle de karşılaşırsınız. Her reaktan kaç mole sahip olduğunuzu öğrendikten sonra, bu oranı reaksiyonu tamamlamak için gereken oranla karşılaştırın. Sınırlayıcı reaktan, diğer reaktandan daha önce kullanılırken, fazla reaktanda, reaksiyon ilerledikten sonra bir artan olacaktır.
Sınırlayıcı reaktan, her bir reaktan tam olarak ne kadar bir reaksiyona katılacağını tanımladığından, teorik verimi belirlemek için stokiyometri kullanılır. Eğer reaksiyon tüm sınırlayıcı reaktant kullanırsa ve tamamlanmaya devam ederse, ne kadar ürün oluşturulabilir şeklindedir. Değer, sınırlayıcı reaktan ile ürün arasındaki molar oran kullanılarak belirlenir.