Kimyasal tepkimelerde kimyasal denge nedir? Kimyasal denge, örnekler ve açıklamalarla konu anlatımı.
Kimyasal Tepkimelerde Kimyasal Denge
Kimyasal tepkimelerin büyük bir kısmı da denge haline ulaşabilir.
ÖRNEK:
tepkimesine göre;
t sıcaklığında kapalı bir kapta başlangıçta A ve B gazları bulunsun. A ve B moleküllerinden eşik enerjisine sahip olanların çarpışmaları sonucu C ve D molekülleri oluşabilir. C ve D gazlarının derişimi zamanla artar. Oluşan C ve D molekülleride birbirleriyle çarpışırlar. Yeterli geri eşik enerjisine sahip olanların çarpışmaları sonucu yeniden A ve B molekülleri oluşabilir.
Başlangıçta ileriye doğru olan tepkime hızı büyüktür. Çünkü A ve B gazlarının derişimi en fazladır. Zamanla, A ve B gazları tepkimeye girip C ve D gazlarını oluşturduğundan ileri tepkime hızı azalırken; geriye doğru olan tepkime hızı artar.
t anında;
İleri tepkime hızı = geri tepkime hızı olur.
Bu durumda tepkimeye girenlerle ürünlerin derişimi sabit kalır. Bu hale kimyasal denge hali denir.
Denge haline ulaşan tepkimeler çift yönlü (tersinir) tepkimelerdir.
Başlangıçta sadece girenlerin olduğu çift yönlü tepkime için
1) Zamana göre derişim grafiği çizilirse:
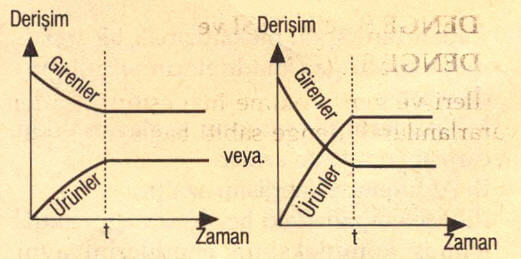
Zamanla girenlerin derişimleri azalırken, ürünlerin derişimleri artar. Bir süre sonra (t anında) giren ve ürünlerin derişimleri sabit kalır. Denge haline ulaşılır.
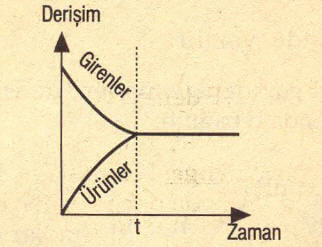
Bazı tepkimelerde denge haline ulaşıldığında girenlerle ürünlerin derişimi eşit olabilir.
2) Zamana göre ileri ve geri tepkime hızları grafiği çizilirse:
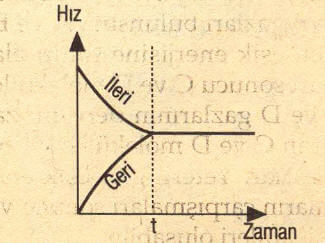
şeklinde olur. t anında kimyasal denge hali oluşur.
KİMYASAL DENGE TANIMLARI
KAPALI SİSTEMDE, SABİT SICAKLIKTA;
1) Gözlenebilir özelliklerin (basınç, sıvı düzeyi, elektriksel iletkenlik, renk gibi) değişmezliği halidir.
2) İleri ve geri tepkime hızlarının eşit olduğa haldir. (Tepkimeye girenlerle, ürünlerin derişimlerinin sabit kaldığı hal)
3) En az enerjili durumla, en düzensiz durumun uzlaştığı haldir.
DENGE BAĞINTISI ve DENGE SABİTİ
İleri ve geri tepkime hızı eşitliklerinden yararlanılarak denge sabiti bağıntısı çıkarılır.
Kapalı bir kapta belirli bir sıcaklıkta,
şeklindeki tersinir bir tepkimede; ileri doğru olan tepkime hızı,
geriye doğru olan tepkime hızı,
şeklindedir.
Denge halinde,
olacağından,
olarak yazılır.
ki ve kg ileri ve geri tepkimeler için hız sabitleri olduğundan; iki sabitin birbirine oranı da sabittir. K ile gösterilir ve denge sabiti adını alır.
► Denge bağıntısında türler derişim olarak verildiğinden K = Kd olarak gösterilir.
► Ürünlerin derişimleri çarpımının, girenlerin derişimleri çarpımına oranı denge sabitini (Kd) verir.
► 1) Çift yönlü tepkimelerde giren ve ürünlerde iki veya daha fazla sayıda faz bulunuyorsa; bu tür dengeler heterojen dengedir. Saf kaü ve sıvıların derişimi sabit kaldığından, bunların derişimi denge sabitinin (Kd) içinde gösterilir. Bu nedenle saf katı ve sıvıların derişimi denge bağıntısında yazılmaz.
ÖRNEK:
ve
sabiti birleştirilerek denge bağıntısı,
şeklinde yazılır.