Periyodik cetvel neyi gösterir? Elementlerin sınıflandırılması nasıl yapılmıştır? Bu konuda çalışan bilim adamları ve tarihi gelişimi.

ELEMENTLERİN SINIFLANDIRILMASI
Doğada 89 element vardır. Laboratuvarda bugüne değin yapılmış olanlarla bu sayı 112 ye çıkmıştır. Bunlar, katı, sıvı ve gaz olabilirler. Doğada bulunan elementlerin 15’i oda sıcaklığında gaz 2’si sıvı geriye kalan 72 element ise katıdır. Günümüzde elementlerin sınıflandırılması temelde iletkenliklerine dayandırılmaktadır. Buna göre metaller ısı ve elektriği iyi iletir, ametaller ise normal koşullarda iletken değildir. Bir kısım elementler ise ısı ve elektriği bir miktar iletirler, ancak metallerin tersine sıcaklıkla artar. Bunlara yarı metaller denir.
Periyodik Cetvel
1869 yılında Alman Lother Mayer ve Rus Dimitri Mendeleev birbirinden habersiz olarak elementlerin artan atom kütlelerine göre sıralanması halinde düzenli olarak tekrarlanan özelliklerin gözlenebildiğine keşfettiler. Mendeleev bu gözlemlere periyodik kanun adını verdi. Elementler bazı benzer özellikleri kullanılarak tarih boyunca birçok bilim insanı tarafından sınıflandırılmaya çalışılmıştır. Böylece elementler sınıflandırıldıklarında daha kolay öğrenilebilir hale gelmiştir.
Johann Döbereiner (1780-1849)
Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner benzer özellik gösteren elementlerden üçlü gruplar oluşturarak gerçekleştirmiştir. Ona göre; lityum, sodyum, potasyum benzer özellikler gösterdiği için bir grup oluşturuyordu.
Alexandre Beguyer de Chancourfois (1820-1886)
Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralamıştır. Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir.
John Newlands (1837-1898)
O devirde bilinen 62 elementi artan atom ağırlıklarına göre sıralamış, ilk 8 elementten sonra benzer fiziksel özelliklerin tekrar ettiğini fark etmiştir.
“Bir numaralı elementten sonra gelen sekizinci element ilk elementin bir çeşit tekrarıdır, tıpkı müzikte bir oktavın sekizinci sesi gibi…” J. Newiands (1864)

Dmitri Mendelyev
Dimitri İvanovic Mendeleyev (1834-1907)
Mendeleyev ve Meyer birbirlerinden habersiz, aynı dönemde elementleri sınıflandırmış ve aynı sıralamayı bulmuşlardır Ancak Meyer elementleri benzer fiziksel özelliklerine göre sıralarken. Mendeleyev bu sıralamada atom ağırlığını göz önünde bulundurmuştur.
Mendeleyev oluşturduğu çizelgede elementlerin düzenli olarak yinelenen özellikler gösterdiğini fark etmiştir. Bu çizelge elementlerin birbirleriyle ilişkilerini yansıtmıştır. Örneğin; soldan sağa doğru gidildikçe element atomlarının proton sayıları; yukarıdan aşağıya doğru gidildikçe element atomlarının katman sayıları artmaktadır. Bu sıralama günümüzde kullanılan elementlerin sınıflandırılmasına yakın bir sıralamadır.
Henry Moseley
Henry Moseley elementlerin fiziksel ve kimyasal özelliklerinin atom kütlesine değil, atom numaralarına bağlı olduğunu kanıtlamıştır. Moseley’in elementleri atom numaralarının artışına göre sıralamasından sonra son değişiklik Glenn Seaborg tarafından gerçekleştirilmiştir. Glenn Seaborg çizelgenin altına iki sıra daha ekleyerek periyodik çizelgeye son şeklini vermiştir.
Element ve element atomları ile ilgili bilgiler içeren çizelgeye periyodik sistem/periyodik tablo adı verilir. Periyodik sistemde elementin adı, sembolü ve element atomunun proton sayısı gibi bilgilere yer verilir. Periyodik sistemde bu yerleşim düzeni, elementlerin özellikleri ile ilgili çok daha fazla bilgiyi içermektedir.
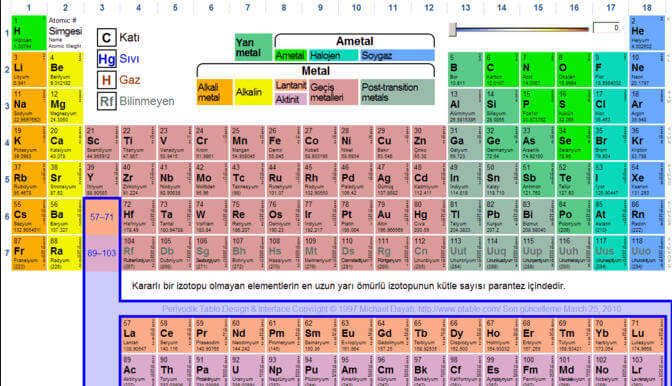
Modern periyodik sistemin özellikleri
Periyodik sistemde sütun ve satırlara yerleştirilmiş 100’den fazla element bulunur. Periyodik sistemi oluşturan tabloda bulunan yatay sıralara periyot denir. Periyodik sistemde toplam 7 periyot bulunmaktadır.
Periyodik sistemde element atomları proton sayılarına göre sıralanırken benzer kimyasal özellik gösteren elementler alt alta sıralanmıştır. Elementlerin oluşturduğu bu dikey sıralara grup denir. Periyodik sistemde toplam 18 grup vardır. Bunlardan 8 tanesi A grubu, 10 tanesi B grubudur.
Her grup ve periyot boyunca elementlerin özellikleri genellikle sistematik bir biçimde değişiklik gösterir. Aynı grupta olan elementler sertlik, parlaklık, iletkenlik gibi özellikleri ve elektron almaya/ vermeye olan yatkınlıkları bakımından birbirine benzerdir.