Kimyasal tepkime hızına hangi faktörler etki eder? Madde türü, derişim etkisi, katalizör etkisi, sıcaklık, etkileşim yüzeyi ve etkileri konu anlatımı.

Kaynak: pixabay.com
Kimyasal Tepkime Hızına Etki Eden Faktörler
1. TEPKİME HIZINA MADDE TÜRÜNÜN ETKİSİ:
Tepkime hızı, tepkimeye giren maddelerin özelliklerine bağlıdır.
- ►Genellikle kompleks yapıya sahip moleküller, basit yapılı molekül veya iyonlara göre daha yavaş tepkime verir.
- ►Bağ kopması fazla olan ve yeniden düzenleme ile yürüyen tepkimelerin hızları oda koşullarında genellikle küçüktür.
- ►Bağ kopması olmaksızın; zıt yüklü iyonlar arasındaki elektriksel çekim kuvveti sonucu oluşan kimyasal tepkimeler hızlıdır.
ÖRNEK:
- 1 –
(çok hızlı)
- 2-
(Hızlı)
- 3-
(Yavaş)
- 4-
(Çok yavaş)
- Tepkimeye girenler yönünden; 3. tepkimenin 2. tepkimeden farkı
yerine
olmasıdır.
- 2. tepkimeye göre 3. tepkime daha yavaş olur. Bunun nedeni
daki bağ koparak yeniden düzenlenmesi sonucu
oluşmasıdır.
2. TEPKİME HIZINA DERİŞİMİN ETKİSİ:
Derişimin artması birim zamanda etkileşen (çarpışan) madde miktarını ve oluşma hızını arttırır.
►Tepkime hızı tepkimeye giren maddelerin molar derişimleri ile doğru orantılıdır.
3. TEPKİME HIZINA SICAKLIĞIN ETKİSİ:
Sıcaklık arttırıldığında tepkimeye giren maddelerin (atomların, moleküllerin ve iyonların) kinetik enerjileri ve buna bağlı olarak da hızları artar. Hızları artan taneciklerin birbiriyle çarpışma sayısı artar. Ayrıca tepkime için gerekli minimum enerji (eşik enerjisi) engelini aşan tanecik sayısı arttığında tepkime hızı artar.
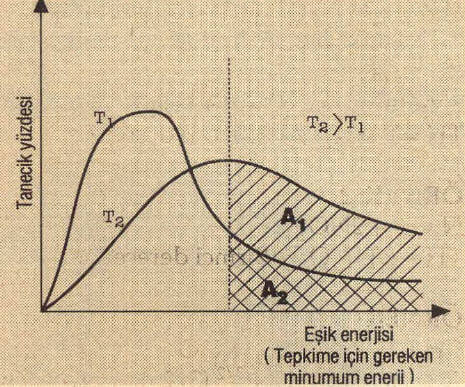
Eşik enerjisi (Tepkime için gereken minimum enerji)
T2 sıcaklığı T1 sıcaklığından büyük olarak verilmiştir. Grafiğe göre; T1 sıcaklığında eşik enerjisini aşan tanecik sayısı A1 kadar iken, T2 sıcaklığında A1 + A2 kadardır. T2 sıcaklığında eşik enerjisini aşan tanecik sayısı artar. Buna bağlı olarak etkin çarpışma sayısı ve tepkime hızı da (TH) artar.
4. TEPKİME HIZINA KATALİZÖRÜN ETKİSİ:
Katalizör: Tepkime hızını değiştiren, tepkime sonunda harcanmadan çıkan maddelerdir.
- ►Katalizörler tepkime sonunda fiziksel değişime uğrasa bile, kimyasal yapısında bir değişme olmaz.
- ►Katalizör denildiğinde genellikle tepkime hızını artıran maddeler anlaşılır.
- ►Tepkime hızını azaltan katalizörlere inhibitör veya negatif katalizörler denir.
- ►Tepkimede oluşan ürünlerden biri katalizör görevini yapabilir. Bu tür maddelere oto katalizör denir.
ÖRNEK:
- tepkimesinde oluşan
otokatalizördür.
- ►Canlıların yapısındaki:biyolojik katalizörlere ENZİM denir.
KATALİZÖRLERİN TEPKİME HIZINI DEĞİŞTİRME NEDENLERİ:
1- Aktifleşmiş kompleksin türünü değiştirebilirler.
2- Düşük enerjili aktifleşmiş kompleks oluşturabilirler.
3-Tepkime mekanizmasını (basamak sayısını) değiştirebilirler.
4-İleri ve geri tepkimelerin aktiflerime enerjilerini aynı miktarda düşürebilirler.
5-Tepkime hız sabitini (k yı) değiştirebilirler.
- ► Katalizörler tepkime ısısı veya tepkime entalpisini değiştirmezler.
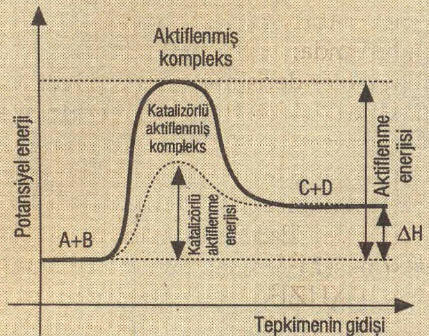
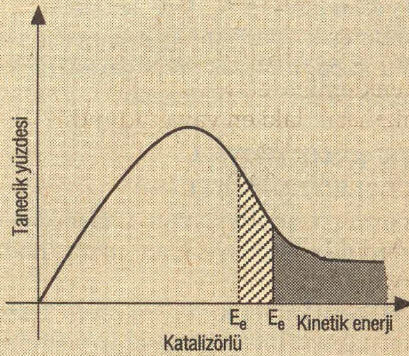
- ►Katalizör kullanıldığında eşik enerjisi azalır. Bu nedenle etkin çarpışan tanecik sayısı arttığı için tepkime hızı artar.
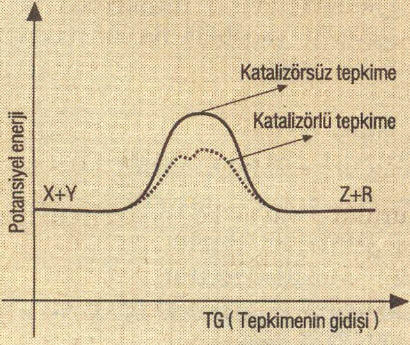
Katalizör mekanizmayı değiştirerek, eşik enerjisini azaldığından tepkime hızını artırır.
5. DEĞME (ETKİLEŞİM) YÜZEYİNİN ETKİSİ:
Farklı fazda etkileşen taneciklerin değme yüzeyleri ne kadar büyük olursa tepkime hızı o kadar fazladır. Aynı miktarda, küçük tanecikli bir madde, büyük tanecikli olana göre daha hızlı tepkimeye girer.
ÖRNEK:
İki deney tüpünden her birine eşit hacim ve molaritede HCl(suda) koyup; 1. tüpe parça halinde CaC03 (k) (kireç taşı), 2. tüpe aynı kütleli toz halinde CaC03 (k) eklenirse 2. tüpteki tepkimenin daha hızlı olduğu görülür.
1 Yorum
faydalıydı sağolun