Kimyasal tepkimelerin hızı nasıl değişir, etkileri, tepkime hızı nasıl ölçülür, örneklerle açıklaması, konu anlatımı.
Kimyasal Tepkimelerin Hızı
Maddelerin birbiriyle etkileşerek tepkimeler vermesi ve bu sırada enerji değişiminin oluşması ne kadar önemli ise; bu etkileşmenin ve enerji değişiminin ne kadar zamanda oluştuğu da önemlidir.
ÖRNEK: Oksijen, altınla doğada kolay etkileşmez.
Demir oksijenle yavaş etkileşerek demir oksit oluşturur. Hidrojen ve oksijen gaz karışımı bir kıvılcımla patlama şeklinde tepkime verir.
►Tepkimelerin hızını ölçen, hız değişmelerinin nedenlerini açıklığa kavuşturan ve mekanizmalarını inceleyen bilim dalma KİMYASAL KİNETİK denir.
TEPKİME HIZI
►Bir kimyasal tepkimede; birim zamanda, madde derişimindeki değişmeye tepkime hızı denir. Birim zaman aralığı; tepkimenin hızına bağlı olarak saniye, gün, ay ve yıl alınabilir.
Madde derişimindeki değişme; birim zamanda tepkimeye girenlerin azalması veya ürünlerin oluşmasındaki artmadır.
Örnek olarak;
tepkimesini inceleyelim.
Zamanla A ve B maddeleri azalacak, AB maddesi ise artacaktır. Zamanı saniye olarak, A, B ve AB maddelerinin molar derişimlerindeki değişmeleri aşağıdaki şekillerde yazabiliriz.
A2 nin tepkimeye girme hızı
B2 nin tepkimeye girme hızı
AB’nin oluşma hızı
►Belirtilen tepkime hızları ortalama tepkime hızlarıdır.
Tepkime hızları arasındaki ilişki ise;
olur.
A2 nin ve B2 nin azalma hızları birbirine eşittir.
AB nin oluşma hızı ise A2 ve B2 nin azalma hızının 2 katı olur.
ÖRNEK:
A2 nin azalma hızı 0,2 mol/l.s ise AB’nin oluşma hızı nedir?
ÇÖZÜM:
►Kimyasal tepkimelerin pek çoğunun hızı, tepkimeye giren maddelerin derişimlerine bağlıdır.
►Tepkime hızı genellikle tepkime ilerledikçe değişir.
►Maddeler tüketildikçe genellikle tepkime hızları yavaşlar.
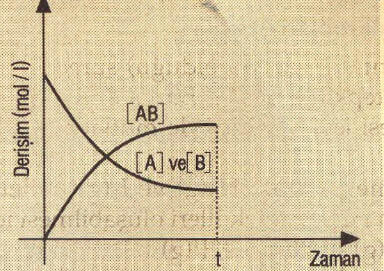
A2 ve B2 nin başlangıçta derişimleri fazladır. Buna bağlı olarak tepkimeye girme hızları da fazladır. Zamanla A2 ve B2 nin derişimi azalırken, tepkimeye girme hızlarının azaldığı aşağıdaki grafikte görülmektedir. AB’nin ise başlangıçta derişimi sıfırken daha sonra arttığı aynı grafikte gösterilmiştir.
TEPKİME HIZLARININ ÖLÇÜLMESİ
Tepkime sırasında değişen derişime bağlı olarak değişen, izlenebilir bir özellikten yararlanılarak tepkime hızları ölçülebilir. Örneğin, tepkime sırasında basınç, hacim, renk ve elektrik iletkenliği vb. özelliklerin değişimi izlenebilir.
ÖRNEK: Aşağıdaki tepkime denklemleri verilmiştir.
I.
II. (Renksiz Kırmızı Renksiz)
III.
Bu tepkimelerin hızlarını belirlemek için hangi yöntemler uygundur?
I. için açıklama: Ürünlerin mol sayısı, girenlerin mol sayısından fazla olduğu için; tepkime süresince basınç azalır. Sabit hacim ve sıcaklıkta basınç azalmasıyla tepkime hızı bulunabilir. Basınç ne kadar hızlı azalırsa tepkime o kadar hızlıdır. Sıcaklık ve basınç sabit tutulursa, hacim azalmasından da tepkime hızı bulunabilir.
II. için açıklama: Ürünlerin mol sayısı, girenlerin mol sayısına eşit olduğundan; tepkime süresince hız, basınç ve hacme bağlı olarak izlenemez. Ancak tepkimeye girenlerden Br2 kırmızı renkli olması, ürünün (HBr) renksiz olmasından dolayı tepkime izlenebilir. Renk ne kadar hızlı kayboluyorsa tepkimede o kadar hızlı oluyor demektir.
III. için açıklama: Elektrik iletkenliği çözeltideki iyonlarla doğru orantılıdır. Girenler iyon halinde olduğu için elektrik iletkenliği fazladır. Ürünler (katı AgCl) oluştukça iletkenlik azalır. Elektrik iletkenliği ne kadar hızlı azalıyorsa, tepkimede o kadar hızlı oluyor demektir.