Moleküler bileşikler nasıl adlandırılır? Adlandırmada kullanılan kurallar ve istisnalar nelerdir? Örneklerle açıklaması
Moleküler Bileşikler
Moleküler bileşikler, ayrı moleküller şeklini alan inorganik bileşiklerdir. Örnekler arasında su () ve karbon dioksit (
) gibi tanıdık maddeler yer alır. Bu bileşikler, sodyum klorür (NaCl) gibi iyonik bileşiklerden çok farklıdır. İyonik bileşikler, metal atomları elektronlarından bir veya daha fazlasını ametal olmayan atomlara kaybettiklerinde oluşur. Ortaya çıkan katyonlar ve anyonlar elektrostatik olarak birbirine çekilir.
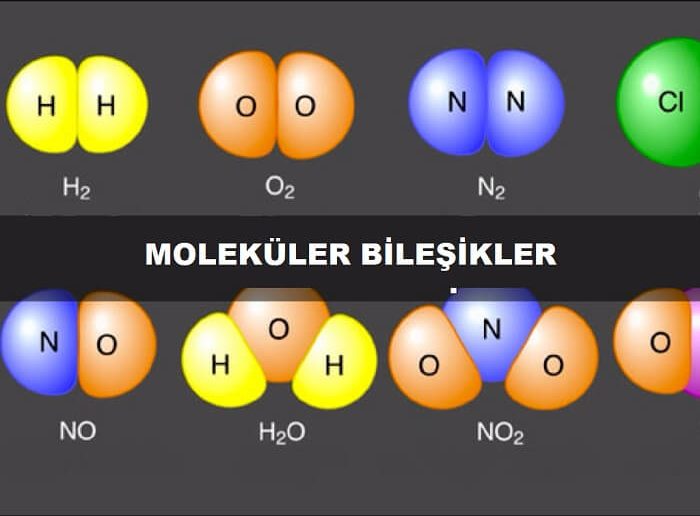
Peki bir molekülün atomlarını bir arada tutan nedir? Bir molekülün atomları iyon oluşturmak yerine elektronlarını atom çiftleri arasında bir bağ oluşturacak şekilde paylaşırlar. Bir karbondioksit molekülünde, her biri karbon atomu ile iki oksijen atomundan biri arasında meydana gelen bu bağlardan ikisi vardır.
Daha büyük moleküller, molekülü bir arada tutmaya yarayan birçok bağa sahip olabilir. Belirli bir moleküler bileşiğin büyük bir örneğinde, tek tek tüm moleküller aynıdır.
İkili Moleküler Bileşiklerin Adlandırılması
Bir moleküler formülün, bir molekülün içerdiği her elementin atom sayısını gösterdiğini hatırlayın. Bir su molekülü iki hidrojen atomu ve bir oksijen atomu içerir, bu nedenle formülü ‘dur. Benzinin bir bileşeni olan bir oktan molekülü, 8 karbon atomu ve 18 atom hidrojen içerir. Oktanın moleküler formülü
‘dir.
İkili (iki elementli) moleküler bileşikleri adlandırmak, basit iyonik bileşikleri adlandırmaya benzer. Formüldeki ilk öğe, basitçe öğenin adı kullanılarak listelenir. İkinci eleman, eleman isminin kökü alınarak ve -ide soneki eklenerek isimlendirilir. Bir moleküldeki atom sayısını belirtmek için sayısal önekler sistemi kullanılır.
- mono-*
- di-
- tri-
- tetra-
- penta-
- hexa-
- hepta-
- octa-
- nona-
- deca-
* Bu önek, ilk öğenin adı için kullanılmaz.
- Genel olarak, birkaç istisna olsa da, daha az elektronegatif öğe ilk önce formülde yazılır. Formülde karbon her zaman ilk sırada yer alır ve
gibi bir formülde hidrojen nitrojenden sonra gelir. İkili bileşik formüllerinde yaygın olarak kullanılan ametallerin sırası C, P, N, H, S, I, Br, Cl, O, F’dir.
- Bir önekin sonundaki a veya o, genellikle öğenin adı sesli harfle başladığında addan çıkarılır. Örnek olarak, dört oksijen atomu, tetraoksit yerine tetroksittir.
- Bir moleküldeki ilk elementin yalnızca bir atomu varsa, “mono” önek ilk elementin adına eklenmez.
Örnekler
- NO nitrojen monoksit
dinitrojen monoksit
disülfür diklorür
diklor heptoksit
Mono-önekin ilk bileşikte nitrojen ile kullanılmadığına, ancak ilk iki örneğin her ikisinde de oksijen ile kullanıldığına dikkat edin. , moleküler bileşikler için formüllerin en düşük oranlarına indirgenmediğini vurgulamaktadır. Mono- ve hepta- nın o, oksit ile eşleştirildiğinde isimden çıkarılır.
Ortak adlara sahip basit moleküler bileşikler
Bazı basit kovalent bileşikler için, sistematik isimler yerine genel isimler kullanırız. Bu bileşiklerle zaten karşılaştık, ancak bunları burada açıkça listeliyoruz:
: su
: amonyak
: metan
: hidrojen peroksit
Metan, en basit organik bileşiktir. Organik bileşikler, karbon atomlu bileşiklerdir ve ayrı bir isimlendirme sistemi ile adlandırılırlar.
Bazı Bileşiklerin Hem Kovalent hem de İyonik Bağları Var
Çok atomlu iyonların ortaya çıkışını hatırlarsanız, çok atomlu iyonları bir arada tutan bağların kovalent bağlar olduğunu hatırlayacaksınız. Çok atomlu iyon kovalent bağlarla oluşturulduğunda, diğer maddelerle iyon olarak reaksiyona girer. Çok atomlu bir iyon ile başka bir iyon arasındaki bağ iyonik olacaktır. Bu tür duruma bir örnek, sodyum nitrat bileşiğindedir. Sodyum nitrat, bir sodyum iyonu ve bir nitrat iyonundan oluşur. Nitrat iyonu kovalent bağlarla bir arada tutulur ve nitrat iyonu sodyum iyonuna bir iyonik bağ ile bağlanır.
Özet
- Bir moleküler bileşik genellikle iki veya daha fazla ametal olmayan elementten oluşur.
- Moleküler bileşikler, element isminin kökü artı -ide soneki kullanılarak önce birinci element ve ardından ikinci element ile adlandırılır.
- Bir moleküldeki atom sayısını belirtmek için sayısal ön ekler kullanılır.