Nötralleşme, nötrleşme tepkimeleri nelerdir, nasıl meydana gelir? Asit ve bazların nötrleşme tepkimeleri örnekler, denklemler.
Nötralleşme Tepkimesi Nedir? Örnekleri
Bir sulu çözeltinin asidik olmasının nedeni çözeltide iyonu sayısının,
iyonu sayısından fazla olmasıdır.
Bir sulu çözeltinin bazik olmasının nedeni ise çözeltideki iyonu sayısının,
iyonu sayısından fazla olmasıdır.
Bir sulu çözeltide H+ iyonu sayısı ile iyonu sayısı eşit ise bu çözelti nötr özellik gösterir. Yani nötr bir çözeltide,
dengesindeki ve
sayıları eşittir.
Bir asit çözeltisine, baz eklenecek olursa asit çözeltisindeki iyonları ile eklenen baz çözeltisindeki
iyonları tepkimeye girerek su oluştururlar.
Bir baz çözeltisine, asit eklenecek olursa baz çözeltisindeki iyonları ile eklenen asit çözeltisindeki
iyonları tepkimeye girerek su oluştururlar.
Asit ve baz çözeltileri eğer uygun ölçülerde karıştırılırsa birbirlerini yok ederler. Sonuçta elde edilen çözelti ne asidik ne de bazik özelliğe sahip olur. Bu tür çözeltiler nötr çözelti olarak adlandırılır.
Bu nedenle asit ve baz çözeltileri karıştırıldığında gerçekleşen tepkimeye nötrleşme (nötralleşme) tepkimeleri adı verilir. Asit çözeltisindeki katyonu ile baz çözeltisindeki
anyonu etkileşerek nötr bir bileşik olan suyu (
) oluşturur.
Sulu çözeltilerde iyonlar arasında bir yük dengesi ve eşitliği vardır. Bu nedenle asidin katyonu ile bazın anyonu nötralleşerek su oluşturduğunda, asidin kalan anyonu ile, bazın kalan katyonu arasında da bir etkileşim gerçekleşerek katyon ve anyondan oluşan bir iyonik bağlı bileşik elde edilir. Kimyada katyon ve anyondan oluşan tüm iyonik bileşikler tuz olarak adlandırılmaktadır.
Örneğin, NaOH bazı ve HCI asidi çözeltileri karıştırıldığında bazın katyonu ile asidin anyonu
birleşerek NaCI tuzunu oluşturur.
ve
iyonları nötrleşerek
oluşturur.
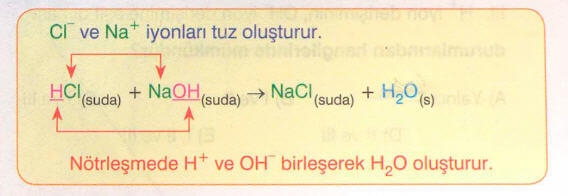
Bir nötrleşmenin olabilmesi için asit baz tepkimesi sonucunda su oluşmalıdır.
Sonuç olarak asit – baz nötrleşme tepkimelerinde tuz ve su oluşur. Aşağıdaki örnek nötrleşme tepkimelerini de inceleyiniz.
Asit + Baz → Tuz + Su