İdeal gaz ve gerçek gaz nedir, nasıl ayırt edilirler? İdeal gaz ile gerçek gaz arasındaki farklar ve benzerlikler nelerdir?
İdeal Gaz vs Gerçek Gaz
Maddenin halleri sıvı, katı ve gazdır ve temel özellikleriyle tanınabilir. Katılar, onlara belirli bir şekil ve kütle veren güçlü moleküler çekim bileşimine sahiptir, sıvılar, moleküller birbirine karşılık gelecek şekilde hareket ettiğinden ve gazlar, moleküller serbestçe hareket ettikleri ve havaya yayıldığı bulundukları ortamın şeklini alır. Gazların özellikleri çok belirgindir. Diğer maddelerle tepkimeye girecek kadar güçlü gazlar vardır, çok güçlü kokuları bile vardır ve bazıları suda çözülebilir. Burada ideal gaz ile gerçek gaz arasındaki bazı farklılıkları not edebileceğiz. Gerçek gazların davranışı çok karmaşıkken, ideal gazların davranışı çok daha basittir. Gerçek gazın davranışı, ideal gazın davranışını tam olarak anlayarak daha somut olabilir.
ÖZET:
-
- İdeal gazın belirli bir hacmi yoktur, gerçek gazın ise belirli bir hacmi vardır.
- İdeal gazın kütlesi yokken gerçek gazın kütlesi vardır.
- İdeal gaz parçacıklarının çarpışması esnektir, gerçek gaz için esnek değildir.
- İdeal gazdaki partiküllerin çarpışması sırasında enerji dahil değildir. Gerçek gazdaki parçacıkların çarpışması enerjiyi çekiyor.
- Basınç, gerçek gaza kıyasla ideal gazda yüksektir.
- İdeal gaz, PV = nRT denklemini takip eder. Gerçek gaz (P + a / V²) (V – b) = nRT denklemini takip eder.
Açıklamalar
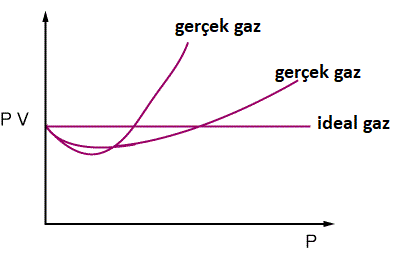
Bu ideal gaz bir “nokta kütlesi” olarak düşünülebilir. Basitçe, kütlesinin neredeyse sıfır olduğu yerde parçacığın son derece küçük olduğu anlamına gelir. Bu nedenle ideal gaz parçacığının hacmi yoktur, gerçek bir gaz parçacığı gerçek hacme sahiptir, çünkü gerçek gazlar son derece küçük olmalarına rağmen tipik olarak biraz yer kaplayan moleküllerden veya atomlardan oluşur. İdeal gazda, parçacıklar arasındaki çarpışma veya çarpmanın elastik olduğu söylenir. Başka bir deyişle, parçacıkların çarpışması boyunca ne çekici ne de itici enerji vardır. Parçacıklar arası enerji eksikliği olduğu için, gaz moleküllerinde kinetik kuvvetler değişmeden kalacaktır. Aksine, gerçek gazlardaki parçacıkların çarpışmalarının elastik olmadığı söylenir. Gerçek gazlar, tıpkı su buharı, amonyak, kükürt dioksit vb. Gibi, itici enerji veya çekici kuvvet harcayarak birbirlerini çok güçlü bir şekilde çekebilen parçacıklardan veya moleküllerden oluşur.
İdeal gazdaki basınç, gerçek bir gazın basıncına kıyasla çok daha fazladır, çünkü parçacıklar, moleküllerin bir çarpışmada çarpıştıklarında geri çekilmelerini sağlayan çekici kuvvetlere sahip değildir. Dolayısıyla parçacıklar daha az enerjiyle çarpışır. İdeal gazlar ile gerçek gazlar arasındaki farklılıklar, en açık şekilde, basınç yüksek olduğunda, bu gaz molekülleri büyük olduğunda, sıcaklık düşük olduğunda ve gaz molekülleri güçlü çekici kuvvetler ortaya çıkardığında açıklanabilir.
PV = nRT, ideal gazın denklemidir. Bu denklem, gazların tüm temel özelliklerini birbirine bağlayabilmesi açısından önemlidir. T, Sıcaklık anlamına gelir ve her zaman Kelvin cinsinden ölçülmelidir. “N”, mol sayısını ifade eder. V, genellikle litre cinsinden ölçülen hacimdir. P, genellikle atmosferlerde (atm) ölçülen basınç anlamına gelir, ancak paskal cinsinden de ölçülebilir. R, asla değişmeyen ideal gaz sabiti olarak kabul edilir. Öte yandan, tüm gerçek gazlar sıvıya dönüştürülebildiğinden, Hollandalı fizikçi Johannes van der Waals ideal gaz denkleminin (PV = nRT) değiştirilmiş bir versiyonunu buldu:
(P + a / V²) (V – b) = nRT. “A” nın değeri ve “b” nin değeri sabittir ve bu nedenle her bir gaz için deneysel olarak belirlenmelidir.