Kimyada elementlerin, bileşiklerin, iyonların ve moleküllerin formülleri nasıl yazılır, bu formülleri yazarken dikkat edilecekler nelerdir?
Semboller, formüller ve denklemler kimyagerlerin kimyasal reaksiyonları ayrıntılı olarak açıklamalarına yardımcı olur.
Kimyasal semboller
Periyodik Tablodaki her element kendi kimyasal sembolü ile temsil edilir.
Kimyasal bir sembolün bir veya iki harfi vardır ve her zaman büyük harfle başlamalıdır. Herhangi bir ikinci harf her zaman küçük olmalıdır.
Örneğin Mg, magnezyum için doğru simgedir, ancak mg, mG ve MG yanlıştır. Kimyasal sembolleri doğru şekilde yazmaya özen gösterin.

Diatomik elementler
Çoğu elementin formülü sadece onların sembolüdür. İstisnalar, diyatomik elemanlar olarak bilinen metal olmayan elementlerdir. Kovalent olarak birbirine bağlanmış aynı elementin iki atomunu içerirler.
Örnekler;
hidrojen
azot
oksijen
florin
klor
bromin
iyot
Aynı kimyasal semboller, hangi dilde olursa olsun, onları çok kullanışlı hale getirecek şekilde tüm dünyada kullanılmaktadır.
Formül yorumlama
Bir formül, bir bileşikte bulunan her atomun türü ve sayısı hakkında bilgi verir.
Sodyum sülfat için formül ‘tür. Sodyum sülfatın şunları içerdiğini söyler:
- iki sodyum atomu
- bir kükürt atomu
- ve dört oksijen atomu
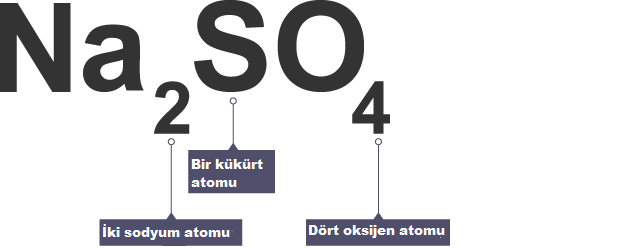
Alt simge numaraları önlerindeki öğeyi ifade eder.
Bazen bir formül parantez içerir. Parantez içindeki atomlar parantez dışındaki sayı ile çarpılır.
Alüminyum sülfat formülü ‘tür. Burada:
- 2 alüminyum atomu
- 3 atom kükürt
- 12 oksijen atomu bulunur.
Bileşikler
Bir bileşik, kimyasal olarak birleştirilen iki veya daha fazla elementtir.
Aşağıdaki tablo bazı yaygın bileşikleri göstermektedir.
- su –
– hidrojen, oksijen
- karbon monoksit – CO – karbon, oksijen
- karbon dioksit –
– karbon, oksijen
- kükürt dioksit –
– kükürt, oksijen
- kükürt trioksit –
– kükürt, oksijen
- azot monoksit – NO – azot, oksijen
- azot dioksit –
– azot, oksijen
- amonyak –
– azot, hidrojen
- hidroklorik asit – HCl – hidrojen, klor
- nitrik asit –
– hidrojen, azot, oksijen
- sülfürik asit –
– hidrojen, sülfür, oksijen
İyonik formüller
İyonik bileşikler pozitif ve negatif iyonlar içerir.
Pozitif yüklerin sayısı, negatif yüklerin sayısına eşit olmalıdır, böylece bileşiğin toplam yükü olmaz. Pozitif iyon üzerindeki yüklerin sayısı negatif iyonla aynı olduğunda, birbirlerini iptal ederler.
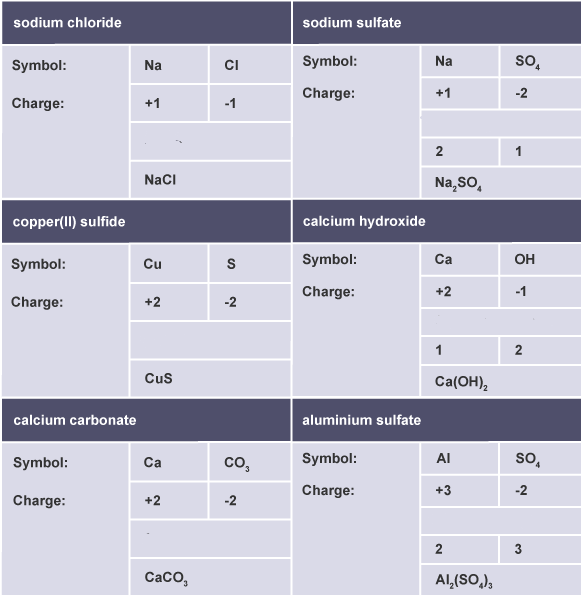
- bileşikteki her iyonun sembolünü ve yükünü yazın.
- işareti yok sayın ve yüklerin sayısı aynı ise, formülü 1: 1 oranında yazın.
- yüklerin sayısı farklıysa, kenarları geçerek yükleri değiştirin, işaretleri bırakın ve formülü yazın.
- moleküler iyonlara dikkat edin – eğer birden fazla varsa köşeli parantez kullanmanız gerekir.