Periyot ve Grup nedir? Kimyada elementlerin Periyot ve Grupları nasıl bulunur? Periyodik cetveldeki elementlerin yerleri ve özellikleri.
Periyot ve Grup Bulma
Elementler periyodik tabloya proton sayılarına göre dizilmişlerdir. Proton sayısı bilinen elementin elektron dağılımı yapılarak periyot ve grubu bulunabilir. Elektron dağılımında katman sayısı periyot sayısını ve son katmandaki elektron sayısı da grup numarasını verir.
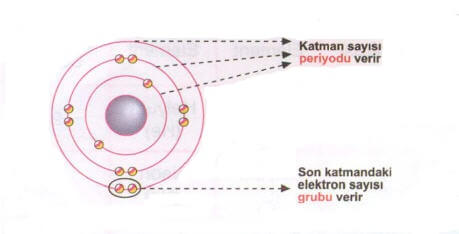
Yukarıda verilen atomun 3 katmanı vardır. Bunun için bu element 3. periyottadır. Son olan 3. katmanında ise 2 elektron vardır, bunun için element 2. gruptadır.
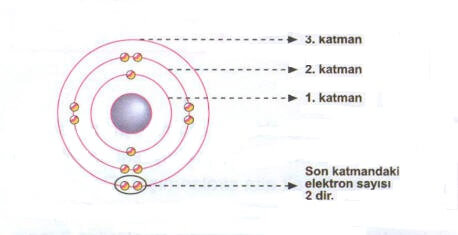
Elementin 1 katmanı vardır ve katmanında 2 elektron vardır.
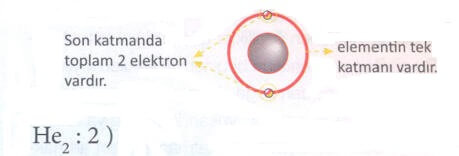
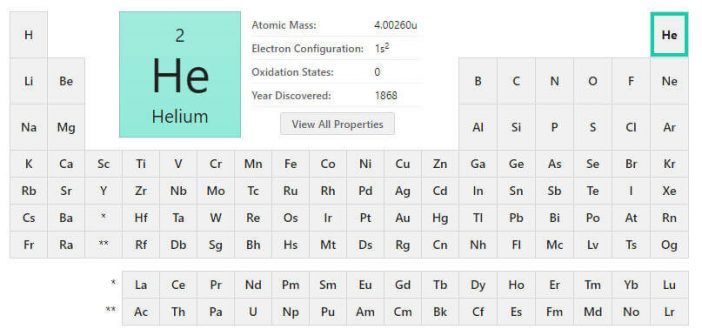
He çok kararlı bir elementtir. Son katmanında 2 elektron olmasına rağmen periyodun en sonunda bulunur. Son grubun adı 8. grup olduğundan He elementi 8. grup elementidir. He2 elementi 1. periyot 8. grup elementidir.
Elementler; Metaller, Ametaller ve Yarı Metaller olmak üzere 3 grupta incelenir.
Aşağıdaki şekilde periyodik sistemde metaller sarı renkle, ametaller mavi renkle; yarı metaller de yeşil renkle gösterilmiş, bir elementin ise henüz özellikleri belirlenemediğinden sınıflandırılmamıştır.
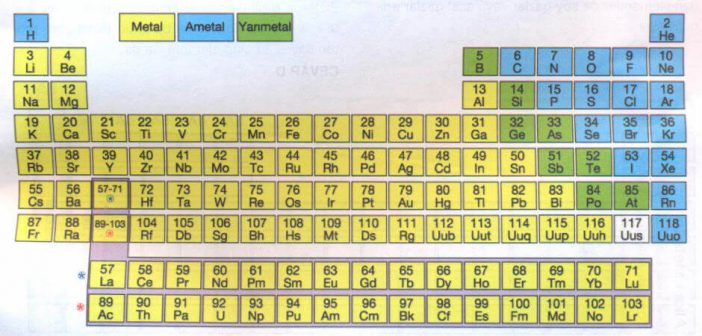
1. METALLER
Periyodik sistemin sol tarafında yer alırlar.
Özellikleri
- Parlak renge sahiptirler.
- Isıyı ve elektriği iyi iletirler.
- Elektron vermeye yatkındırlar.
- Bileşik oluşturduklarında sadece + yüklü iyon (katyon) oluştururlar.
- Çekiç ile dövülerek levha haline getirilebilirler
- Çekilerek tel haline getirilebilirler.
- Birbirleri ile bileşik oluşturmazlar.
- Son katmanlarında 1 – 3 elektron bulunur.
- Büyük çoğunluğunun erime ve kaynama noktası ametallere göre çok yüksektir.
2. AMETALLER
Periyodik sistemin sağ tarafında yer alırlar.
Özellikleri
- Mat renklidirler.
- Isı ve elektriği çoğunlukla iletmezler. (Bazıları çok az da olsa iletir.)
- Oda şartlarında katı sıvı ya da gaz halinde olanları bulunur. Örneğin hidrojen, azot, helyum, klor gibi elementler oda sıcaklığında gaz halinde bulunur. Brom elementi sıvı bir ametaldir. Karbon, fosfor, kükürt ve iyot ise oda sıcaklığında katı halde bulunur.
- Elektron almaya yatkınlardır.
- Tel ve levha haline getirilemezler.
- Katı olanları kırılgan yapıdadırlar, dövülemezler.
- Birbirleri ile bileşik oluşturabilirler.
- Genellikle son katmanlarında 4 – 8 elektron bulunur.
- Erime ve kaynama noktaları (karbon hariç) metallere göre oldukça düşüktür.
- Bileşik olduklarında çoğunlukla (-) yüklü iyonları (anyon) oluştururlar. Bununla beraber bazı ametaller (+) yüklü iyonlar da oluşturabilirler.
3. YARI METALLER
Periyodik sistemde hem metallerin hem de ametallerin özelliklerin bir arada taşıyan elementler vardır. Bu sınıfta yer alan elementler yarı metal olarak adlandırılır.
Yarı metaller bazı fiziksel özellikleri ve görünüşleri yönünden metallere, kimyasal özellikleri bakımından daha çok ametallere benzer.
Bor, silisyum, germanyum, arsenik, antimon, tellür, polonyum ve astatin olmak üzere 8 yarı metal vardır.
Özellikleri
- Parlak ya da mat olabilirler.
- Metallere göre az, ametallere göre ise daha iyi elektrik akımı ve ısıyı iletebilirler. (Yarı iletken özelliktedirler)
- Yarı metaller özellikle elektronik devre parçalarının ve optik malzemelerin yapımında kullanılırlar.
- Kırılgan değildir, işlenebilir.
- Yarı metaller elektronik devre elemanlarında ve birçok alanda kullanılmaktadır. Örneğin; bu elementler kamera ve mikroskop mercekleri ilet projektörlerde yarı iletkenlik özelliğinden dolayı tercih edilmektedir.