Redoks Tepkimeleri nedir, nasıl oluşur? Redoks Tepkimelerinin çeşitleri, özellikleri nelerdir? Redoks Tepkimeleri örnekleri, hakkında bilgi.
Redoks Tepkimeleri
- Kombinasyon reaksiyonlarında iki element birleştirilir.
- Ayrışma reaksiyonlarında, bir bileşik bileşen kısımlarına ayrılır.
- Yer değiştirme reaksiyonlarında, bir veya daha fazla atom diğeri ile değiştirilir.
- Yanma reaksiyonlarında, bir bileşik oksijen ile reaksiyona girerek karbondioksit, su ve ısı üretir.
- Orantısızlaştırma reaksiyonlarında, bir molekül hem indirgenir hem de oksitlenir; bu tip reaksiyonlar nadirdir.
Redoks reaksiyonları her yerdedir. Aslında, teknolojimizin çoğu, ateşten dizüstü bilgisayar pillerine kadar, büyük ölçüde redoks reaksiyonlarına dayanmaktadır. Redoks (indirgeme-oksidasyon) reaksiyonları, reaktanların oksidasyon durumlarının değiştiği reaksiyonlardır. Bu, bu tür reaksiyonlarda, elektronların her zaman türler arasında aktarılması nedeniyle oluşur. Redoks reaksiyonları, karbon dioksit () elde etmek için oksijenin karbonun yakılması gibi basit bir işlemle veya elektron transferi yoluyla insan vücudundaki glikozun (
) oksidasyonu gibi daha karmaşık bir işlemle gerçekleşir.
“Redoks” terimi, elektron transferiyle ilgili iki kavramdan gelir: indirgeme ve oksidasyon. Bu işlemler aşağıdaki gibi tanımlanır:
Oksidasyon, bir molekül, atom veya iyon tarafından elektron kaybı veya oksidasyon durumunda bir artıştır.
İndirgeme, elektronların kazanımı veya bir molekül, atom veya iyon tarafından oksidasyon durumunda bir azalmadır.
Redoks reaksiyonları eşleşen setlerdir: bir tür bir reaksiyonda oksitlenirse, diğeri azaltılmalıdır. Beş ana redoks reaksiyonu türüne bakarken bunu aklınızda bulundurun: kombinasyon, ayrışma, yer değiştirme, yanma ve orantısızlık.
Kombinasyon
Kombinasyon reaksiyonları kimyasal bir bileşik oluşturmak için elementleri “birleştirir”. Her zamanki gibi, oksidasyon ve indirgeme birlikte oluşur.
Genel denklem: şeklindedir.
Örnek;
Reaktanlardaki oksidasyon durumlarının toplamı, ürünlerdekine eşittir:
Bu denklemde, hem hem de
, kendi elementlerinin moleküler formlarıdır ve bu nedenle oksidasyon durumları 0’dır. Ürün
‘dur: oksidasyon durumu, oksijen için -2 ve hidrojen için +1’dir.
Ayrışma
Ayrışma reaksiyonları, kombinasyon reaksiyonlarının tersidir, yani kimyasal bir bileşenin bileşen elemanlarına parçalanmasıdır.
Genel denklem:
Örnek;
Bu denklemde su, her ikisi de nötr olan hidrojen ve oksijene “ayrışır”. Önceki örneğe benzer şekilde, ‘nun toplam oksidasyon durumu 0’dır, her bir H bir +1 durumunu ve O -2’yi alır; böylece, ayrışma oksijeni -2’den 0’a oksitler ve hidrojeni +1’den 0’a düşürür.
Yer değiştirme
Değiştirme reaksiyonları olarak da bilinen yer değiştirme reaksiyonları, bileşikler ve elementlerin “değiştirilmesini” içerir. Tek ve çift replasman reaksiyonları olarak ortaya çıkarlar.
Genel denklem (tek yer değiştirme):
Tek bir değiştirme reaksiyonu, reaktanlardaki bir elementi ürünlerdeki başka bir elementle “değiştirir”.
Örnek;
Bu denklemde Cl indirgenir ve Br yerine geçer, Br oksitlenir.
Genel denklem (çift yer değiştirme):
Bir çift ikame reaksiyonu, tek bir ikame reaksiyonuna benzer, ancak reaktanlardaki iki elementin, ürünlerdeki ikiyle “değiştirilmesini” içerir.
Örnek;
Yanma
Yanma reaksiyonları her zaman oksijen ve organik bir yakıt içerir. Aşağıdaki görüntüde, enerjiyi serbest bırakmak için metanın yanıcı olduğunu görüyoruz.
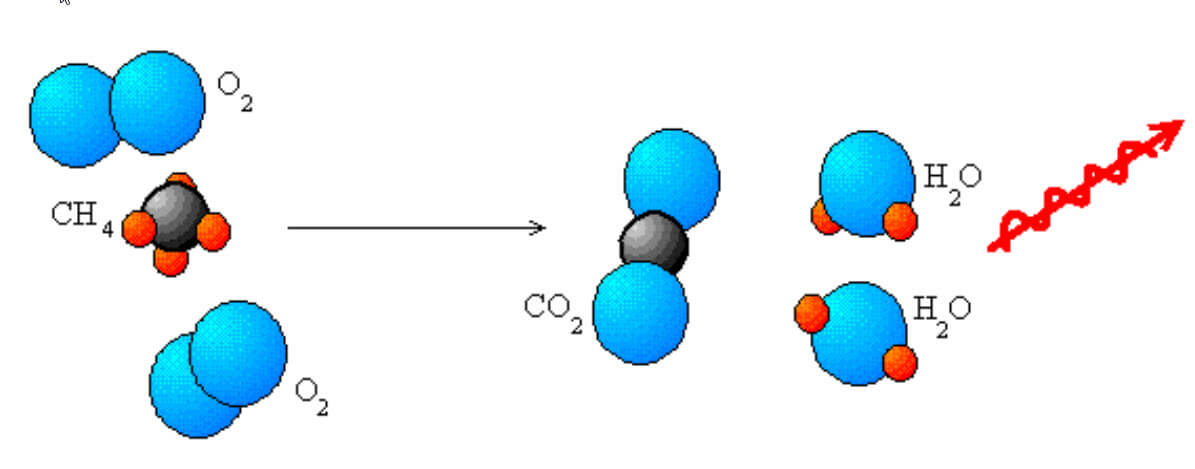
Metanın yanma reaksiyonu
Bu bir yanma reaksiyonu, redoks işlemi örneğidir. Metan , oksijenle reaksiyona girer
karbon dioksit
ve iki su molekülü
.
Bir yanma reaksiyonunun genel denklemi:
Disproporsiyonu (Orantısızlaştırma)
Bazı redoks reaksiyonlarında, maddeler hem oksitlenebilir hem de azaltılabilir. Bunlar orantısızlaştırma reaksiyonları olarak bilinir. Böyle bir işlemin gerçek hayattan bir örneği, bir yaranın üzerine döküldüğünde hidrojen peroksit ‘nin reaksiyonudur. İlk başta, bu basit bir ayrışma reaksiyonu gibi görünebilir, çünkü hidrojen peroksit oksijen ve su üretmek için parçalanır:
Bununla birlikte, bu reaksiyonun anahtarı oksijenin oksidasyon durumlarında yatmaktadır. Reaktanda ve her iki üründe de oksijen bulunduğuna dikkat edin. ‘de oksijenin -1 yükseltgenme durumu vardır.
‘da oksidasyon durumu -2’dir ve azaltılmıştır. Bununla birlikte
‘de oksidasyon durumu 0’dır ve oksitlenmiştir. Oksijen reaksiyonda oksitlenir ve indirgenir, bu da orantısızlaştırma reaksiyonu olur. Bu reaksiyon için genel form aşağıdaki gibidir:
şeklindedir.