Schrödinger Dalga Denklemi nedir, neyi ifade eder? Dalga fonksiyonu nedir, denklemin sonuçları. Dalga Gibi Davranan Parçacıklar Ve Daha Fazlası…

Schrödinger Dalga Denklemi
Eğer parçacıklar da dalga gibi yayılabiliyorsa, nerede olduklarını nasıl söyleyebiliriz? Erwin Schrödinger dalga gibi davranan bir parçacığın bulunabileceği konumu ihtimale bağlı olarak veren çığır açıcı bir denklem buldu. Bu denklem atomlarda elektronların enerji düzeylerini de verdiği için kuantum mekaniğinin yanı sıra modern kimyayı da başlatmıştır.
Einstein ve Louis-Victor de Broglie’ye göre parçacıklar ve dalgalar iç içedir. Işığın da aralarında olduğu elektromanyetik dalgalar, her ikisinin özelliğini de gösterir ve hatta atomaltı parçacıklar ile moleküller bile tıpkı dalgalar gibi kırınabilir ve girişim yapabilir.
Fakat dalgalar sürekliyken parçacıklar değildir. Bu durumda dalga gibi yayılmış haldeki bir parçacığın nerede bulunduğunu nasıl söyleyebiliriz? Avusturyalı fizikçi Erwin Schrödinger‘in 1926’da bulduğu denklem, dalga fiziğini ve olasılığı kullanarak dalga gibi davranan bir parçacığın belli bir konumda bulunma ihtimalini verir. Bu denklem atomik dünyanın fiziği olan kuantum mekaniğinin köşe taşlarından biridir.
Denklem ilk olarak atomlarda elektronların konumlarını belirlemek için kullanıldı. Schrödinger elektronların dalga-benzeri hareketini betimlemeye çalıştı ve Max Planck’ın fiziğe kazandırdığı enerji kuantası kavramını dahil etti. Kuanta fikrine göre enerji, dalganın frekansıyla orantılı enerji blokları halinde geliyordu. Kuantalar dalgalara tanecikli olmanın temel özelliğini veren en küçük yapılardır.
Bohr atomu
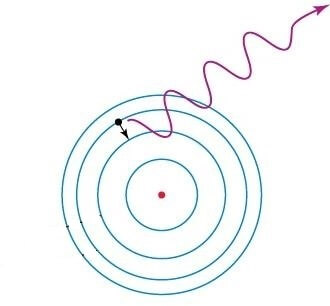
Kuantize, yani sürekli değil de kesikli enerji fikrini atomun elektronlarına uygulayan kişi Danimarkalı fizikçi Niels Bohr oldu. Elektronlar atomlarından kolayca koparılıp serbest bırakılabildiğinden ve eksi yüklü olduklarından, Bohr tıpkı Güneş’in çevresinde dönen gezegenler gibi elektronların da artı yüklü bir çekirdeğin çevresindeki yörüngelerde döndüğünü düşündü. Bununla birlikte elektronlar, yalnızca temel enerji kuantasının katlarına karşılık gelen belli enerjilere sahip olabiliyordu. Atomdaki elektronlar için bu enerji seviyeleri, elektronların yalnızca belli bazı tabakalarda (veya “kabuklarda”) bulunabileceği anlamına geliyordu. Gezegenler de enerjilerine bağlı olarak yalnızca belli bazı yörüngelerde dönebiliyor olsaydı bu aynı durum olurdu.
Bohr’un modeli çok başarılıydı. Özellikle basit hidrojen atomunu çok iyi açıklıyordu. Hidrojenin çekirdeğinde artı yüklü tek bir proton ve onun çevresinde dönen tek bir elektron vardır. Bohr’un kuantize enerjilerden oluşan hiyerarşisi, hidrojenin soğurduğu ve yaydığı ışıkların özgün dalgaboylarını kavramsal olarak açıklıyordu.
Hidrojen atomunun elektronu enerji verildiğinde bir merdiveni tırmanır gibi üst basamaklara veya kabuklara sıçrayabilir. Üst basamaklardan birine sıçrayabilmesi için elektronun bir fotondan tam da bu iş için gereken miktarda enerji soğurması lazımdır. Dolayısıyla elektronun bulunduğu enerji düzeyini arttırabilmek için belli bir frekansta ışık gerekir. Başka frekanslarda ışıklar işe yaramaz. Üst enerji düzeyine çıkmış bir elektron da daha düşük bir basamağa geri düşebilir. Bu sırada o enerji düzeyine çıkması için gereken frekansta bir fotonu geri yayar.
Tayftaki parmak İzleri
Hidrojenin elektronu enerji merdiveninde üst basamaklara çıkarken, kendine özgü enerji düzeyleri arasındaki farklara karşılık gelen belli frekanslarda fotonlar soğurur (emer). Hidrojen gazına beyaz ışık verildiğinde, bu frekanslardaki ışıklar soğrulur ve kararırlar. Eğer hidrojen sıcaksa ve elektronları merdivende yukarılardaysa, yaydıkları fotonlardan dolayı parlak çizgiler oluşur. Hidrojene özgü bu enerjiler ölçülebilir ve ölçümler de Bohr’un öngörüleriyle uyumlu çıkar.
Her atom kendine özgü farklı enerjilere karşılık gelen benzer çizgiler oluşturur. Bu çizgiler bir bakıma her kimyasal türü ayırt etmeye yarayan parmak izleridir.
Kutuda sıkışmış
Uzayda serbestçe ilerleyen yalnız bir parçacığın sinüs dalgasına benzeyen bir dalga fonksiyonu vardır. Bu parçacık bir kutunun içine hapsedilirse, dalga fonksiyonu kutunun duvarları ve kutunun dışı için sıfıra düşer, çünkü parçacık oralarda bulunamaz. Kutunun içindeki dalga fonksiyonu, parçacığın izin verilen enerji düzeyleri, yani enerji kuantaları göz önüne alınarak belirlenebilir. Kuantum kuramı yalnızca belli enerji düzeylerine izin verdiği için, parçacığın kutunun içinde belli yerlerde bulunma olasılığı, diğer yerlere göre daha yüksektir. Ayrıca dalga fonksiyonunun sıfır olduğu yerlerde bulunma olasılığı hiç yoktur. Daha karmaşık sistemlerin dalga fonksiyonları, tıpkı müzik tınılarının birçok harmonikten oluşması gibi, birçok sinüs dalgasının ve diğer matematiksel fonksiyonların bileşiminden oluşur. Klasik fizik olsaydı, kutunun içindeki parçacığın (örneğin minik bir bilyenin) hareketini ifade etmek için Newton’ın yasalarını kullanırdık. Herhangi bir anda nerede olduğunu ve hareket yönünü tam olarak bilirdik. Ne var ki kuantum mekaniğinde parçacığın belli bir anda belli bir yerde bulunmasının ancak olasılığından söz edebiliriz. Atom ölçeğinde enerji kuantize olduğu için, parçacığın bulunmayı yeğlediği belli yerler vardır. Ama hiçbir zaman nerede olduğunu tam olarak söyleyemeyiz, çünkü aynı zamanda dalgadır.

Dalga fonksiyonu
Bohr’un enerji düzeyleri hidrojende çok iyi işliyordu. Ama çekirdeği daha ağır olan ve birden çok elektronu bulunan atomlarda o kadar iyi değildi. De Broglie’nin elektronların dalga olarak da düşünülebileceği ikilemi ise olduğu gibi duruyordu. Dolayısıyla her elektronun yörüngesi bir dalga cephesi olarak düşünülebilirdi. Ama elektronu dalga olarak düşünmek, nerede olduğu sorusunu yanıtlamayı imkânsızlaştırıyordu.
De Broglie’den esinlenen Schrödinger, dalga gibi davranan bir parçacığın konumunu gösteren bir denklem buldu. Bunu ancak olasılıktan yararlanarak istatiksel olarak yapabilmişti. Schrödinger’in bu önemli denklemi, kuantum mekaniğinin temel öğelerinden biridir.
Schrödinger’in dalga fonksiyonu fikrini ortaya atmasının nedeni, bir parçacığın herhangi bir zamanda belli bir konumda bulunma olasılığını söyleyebilmek, ayrıca parçacıkla ilgili bilinebilecek tüm bilgileri içeren bir matematiksel ifade ortaya koyabilmekti. Dalga fonksiyonu, anlaşılmasının zorluğuyla ünlüdür. Kendi yaşamımızda hiç böyle bir şeyle karşılaşmadığımızdan, bırakalım zihnimizde canlandırmayı, felsefeyle yorumlamamız bile zordur.
Schrödinger denkleminin açtığı çığır, elektronların orbitallerde dolaştığı atom modellerini de beraberinde getirdi. Orbitaller elektronların %80-90 ihtimalle bulunduğu olasılık bölgeleridir (Ayrıca buradan, küçük ihtimalle de olsa bambaşka yerlerde bulunabilecekleri sonucu da çıkar). Bu bölgeler, Bohr’un zihninde canlandırdığı gibi küresel kabuklar şeklinde değildir. Gerçekte halteri veya simidi andıran şekilleri vardır. Günümüzde kimyacılar bu bilgileri yeni moleküller oluşturmakta kullanır.
Schrödinger denklemi dalga-parçacık ikiliği fikrinin yalnızca atomlar için değil, tüm maddeler için geçerli olduğunu göstererek fizikte bir devrim yaratmıştır. Werner Heisenberg ve diğerleriyle birlikte, Schrödinger de kuantum mekaniğinin kurucularından biri kabul edilir.