Tuzun yapısı ve özellikleri nelerdir? Tuz neden oluşur? Tuzu oluşturan daha küçük yapılar nelerdir, tuzdaki bileşikler ve bağlar nelerdir?

Kaynak: pixabay.com
NaCl olarak da bilinen kaya tuzu, iyonik bir bileşiktir. Doğal olarak beyaz kübik kristaller halinde oluşur. NaCl’nin yapısı birim hücre tekrarlanarak oluşturulur. Organize bir yapıya sahiptir ve 1: 1 Na: Cl oranına sahiptir.
Kaya tuzu (NaCl), beyaz kristaller olarak doğal olarak oluşan iyonik bir bileşiktir. Mineral halit formundan veya deniz suyunun buharlaşmasından elde edilir. NaCl’nin yapısı, yüz merkezli kübik birim hücrenin tekrarlanmasıyla oluşturulur. Molar kütlesi 58.4 g / mol olan 1: 1 Na: Cl stokiyometri oranına sahiptir. Sodyum klorür yapısına sahip bileşikler arasında alikali halojenürler ve metal oksitler ve geçiş metali bileşikleri bulunur. Birçok önemli uygulama için önemli bir rol, suyun yapısı ve dinamiğidir. Bazı uygulamalar, proteinlerin kristalleşmesini ve peptitlerin ve nükleik asitlerin konformasyonel davranışını içerir.
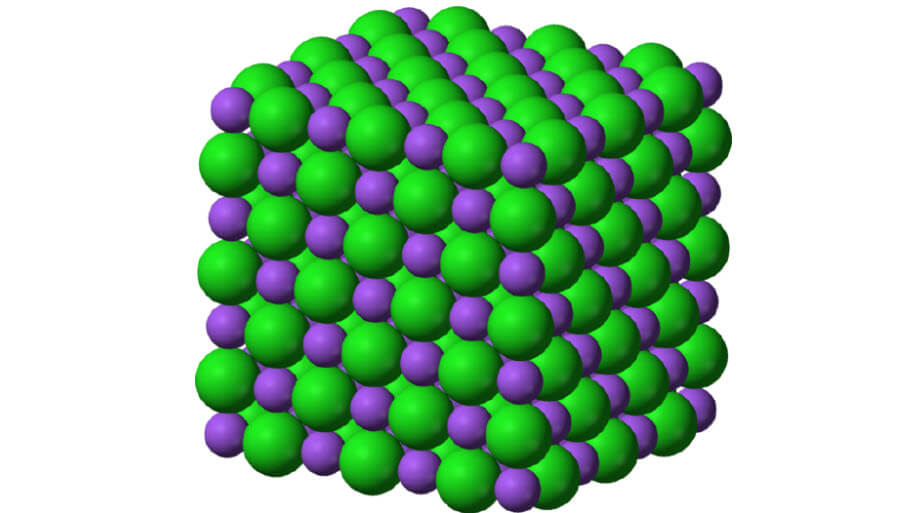
Sodyum klorürün kristal yapısı, tipik bir iyonik bileşik olan NaCl. Daha küçük mor küreler sodyum katyonlarını, Na + ‘yı temsil eder ve daha büyük yeşil küreler klorür anyonlarını, Cl− temsil eder.
Yapısı
Şekilde, Na+ ve Cl- iyonlarının alanı nasıl kapladığı görülmektedir. Daha küçük iyonlar, 102 pm’lik bir atom yarıçapına sahip Na + ve daha büyük iyonlar, 181 pm’lik bir atomik radyuma sahip Cl- ‘dir. NaCl, bileşik olarak bire bir oran olduğundan, Na ve Cl’nin koordinasyon sayıları eşittir. Daha büyük yeşil iyonlar Cl-‘yi temsil eder ve daha küçük mor iyonlar Na + ‘yı temsil eder. Bununla birlikte, bu molekülün yapısı, koordinasyon numaraları eşdeğer olduğu için konumlarının değiştirilmesine izin verir.
Bu kafesteki her iyon, en yakın komşuları olarak diğer türden altı iyona ve ikinci en yakın komşularıyla aynı türden on iki iyona sahiptir. Na, Li, K ve Rb’nin diğer tüm halojenürleri dahil olmak üzere bu yapıyı alan birçok iyonik bileşik vardır. CsF, AgF, AgCl, BaO, CoO ve SrS de NaCl’ye benzer yapılar oluşturacak olanların çoğu arasındadır.
Tuz Nasıl Birbirine Bağlanır?
İyonları birbirine bağlayan yapıştırıcıyı anlamadan önce, belirli atomların neden iyon haline geldiğini öğrenmemiz gerekiyor. İyonlar iki yoldan biriyle oluşur. İlk olarak, bir atom katyon olmak için bir elektron kaybedebilir. Elektronların negatif yüklü olduğunu unutmayın, yani bir atom negatif yük kaybederse, pozitif olur.
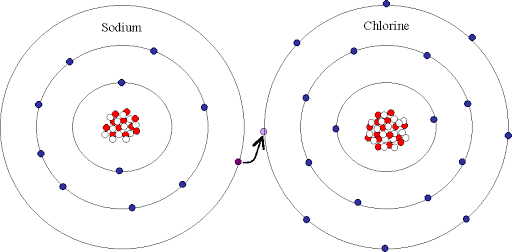
Bir atom ayrıca anyon olmak için bir elektron kazanabilir. Bu, atomun elektron dağılımı ve sekiz numaralı sihirli sayı nedeniyle olur. Kimyagerler genellikle sekizli kuralına atıfta bulunurlar; bu, basitçe ifade etmek gerekirse, bir atomun sekiz değerlik veya dış elektron alabildiğinde kararlılığa ulaşacağı anlamına gelir. Atom, periyodik tablodaki en yakın asal gaza benzer olacaktır. Bunun başarılmasının bir yolu, bir iyon oluşturmak için elektronları kaybetmek veya kazanmaktır.
Metallerin elektron kaybederek katyonlar oluşturur. Örneğin, sodyum bir grup 1 metalidir ve tüm grup 1 metalleri gibi, bir değerlik elektronuna sahiptir. Bu elektron atom tarafından çok sıkı tutulmaz ve kolayca kaybolur, bu da Na1 + katyonunu oluşturur.
Klor ametal değildir ve periyodik tablodaki grup 17’de (veya 7A) bulunur. Yedi değerlik elektronuna sahiptir ve kararlılık için sihirli sekize ulaşmak için sadece bir elektrona daha ihtiyacı vardır! Bu ekstra elektronu elde etmek Cl1- anyonunu oluşturacaktır. Her iki iyonun da (Na1 + ve Cl1-) aynı sayıda yüke sahip olduğuna dikkat edin, tam tersi işaretler.
Peki, bir metal sodyum atomu, gaz halindeki bir klor atomuyla karşılaştığında ne olur? Her iki atom da iyon oluştururken şiddetli bir reaksiyon meydana gelir. Sodyum fazladan elektronunu klora aktarır – bu da klora sihirli sekiz değerlik elektronunu verir ve sodyuma pozitif bir yük verir.
Bu iyonlar hemen birbirlerine çekilir ve tuz sodyum klorür oluşur. İyonlar, zıt yüklü iyonlar arasındaki elektrostatik çekim olan zıt yüklü iyonlar arasındaki elektrostatik çekim olan iyonik bağlarla birbirine yapıştırılır.
Tuzun Özellikleri Nelerdir?
Malzemelerin fiziksel ve kimyasal özellikleri birbirine nasıl bağlandıklarına yakından bağlıdır. Artık bir tuzdaki iyonların güçlü iyonik bağlar oluşturarak birbirlerine kuvvetle çekildiğini biliyoruz. İyonik bir bağı koparmak için çok fazla enerji gerekir ve çekim ne kadar güçlüyse bağ o kadar güçlüdür. İyonlar arasındaki bu çekim, iyonik bağlara sahip bir bileşiğin güçlü, düzenli bir yapıya sahip olacağı anlamına gelir.

Kaynak: pixabay.com
Tuzlar genellikle bir kristal yapı veya oldukça düzenli bir molekül oluşumu olan kristal kafes oluşturur. Bu yüzden patates kızartmalarımızda tuz kristalleri alıyoruz.
Bu düzenli yapı ve güçlü iyonik bağ, birçok tuzun bazı özel özelliklere sahip olmasına neden olur. Birincisi, kristal yapıları olan kristal katı olma eğilimindedirler. Katılar ayrıca kristal boyunca güçlü iyonik bağ nedeniyle sert ve kırılgan olma eğilimindedir. Tuzlar ayrıca yüksek kaynama ve erime noktalarına sahiptir çünkü bu bağları kırmak ve tuzun madde durumunu değiştirmek çok fazla enerji gerektirir. Son olarak, tuzlar elektrolitlerdir, yani suda çözünerek elektriği iletebilen serbest hareket eden iyonlar oluştururlar.
Yine de erimiş tuzlar elektrik iletirken katı tuzlar bunu yapmaz; iyonlar elektriği iletmek için serbest olmalıdır.