Asitler metallerle nasıl tepkime verir? Asitlerin metallerle tepkime örnekleri, denklemleri ve kuralları hakkında bilgi.
Asitlerin Metallerle Tepkimeleri
Asitler suda çözündüklerinde suya iyonu veren maddelerdir. Yani asitlerin katyonu
iyonudur. Asitlerin yapısında bulunan hidrojen elementi elektron alma yatkınlığı en küçük olan ametaldir. Bileşiklerini oluştururken yapısındaki elektronunu büyük ölçüde kaybeder. Metaller de bileşik oluştururken elektron veren elementlerdir. Metal atomlarının kendi aralarında elektron verme yatkınlıklarının bir sıralaması vardır. Örneğin 1A grubunda yer alan alkali metallerin elektron verme yatkınlıkları, diğer gruplarda bulunan metallere göre en büyüktür.
Elektron verme yatkınlığı büyük olan metaller, küçük olan metallere göre daha aktiftir.
Metallerin elektron verme yatkınlıklarının karşılaştırılması genellikle 4 farklı grupta yapılır.
1. grup : Li > K > Ba > Sr > Ca > Na
Bu grupta yer alan metaller soğuk su ile bile reaksiyon verebilecek kadar aktiftir.
Li, K, Ba, Sr, Ca ve Na metalleri su ile tepkime verdiklerinde bu metallerin bazlarının sulu çözeltisi oluşur. Tepkimelerde gazı açığa çıkar.
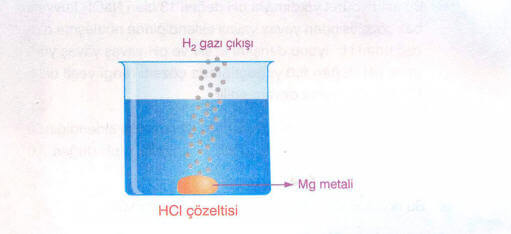
2. grup : Mg > Al > Mn > Zn > Cr > Cd > Fe
Bu grupta yer alan metaller yüksek sıcaklıkta su ile tepkimeye girebilmektedirler.
3. grup : Co > Ni > Sn > Pb > 
Bu grupta yer alan metaller kızgın kor hâlindeyken su buharı ile tepkime verebilmektedirler.
4. grup : Cu > Hg> Ag > Pt >Au
Bu grupta yer alan metaller hidrojen elementinden bile pasiftir. Yani elektron verme yatkınlıkları hidrojenden küçüktür. Bu gruptaki metaller soy metaller olarak adlandırılırlar.
Elektron verme yatkınlığı H atomundan büyük olan metaller, asitlerle tepkimeye girerek elementel hâlde
gazı ve tuz oluştururlar.
Öyleyse yukarıda verilen element gruplarından ilk 3 grupta yer alan tüm metaller asitler ile tepkimeye girerek
gazı oluşturabilirler.
Asit özelliğine sahip maddeler kendileriyle tepkimeye giren metalleri aşındırırlar. Metallerin asitlerle tepkimesi sonucunda H2 gazı oluşurken, metalin asitteki anyon ile birleşmesi sonucunda tuz oluşur. Oluşan tuz sudaki çözünürlük durumuna göre çözelti içinde iyonları hâlinde ya da dipte katı bir çökelek hâlinde bulunur.
Aşağıdaki tepkime denklemlerini inceleyiniz…
Elektron verme yatkınlığı H atomundan küçük olan metaller, asitlerle tepkime vermezler. Öyleyse yukarıda verilen element gruplarından 4. grupta yer alan metaller asitler ile tepkimeye girmezler.
Ancak bu durumun bir istisnası vardır.
4, grupta yer alan metallerden Cu, Hg ve Ag yarı soy metaller olarak sınıflandırılırlar. Bu metaller yapısında oksijen atomu içeren ve kuvvetli olan asitler ile tepkime verebilmektedirler. Gerçekleşen tepkime sonucunda
gazı oluşmaz. Bunun yerine tuz ile birlikte asitteki ametal atomunun oksijenli bir bileşiği ve su oluşur.
Diğer iki soy metal olan Pt ve Au ise hiç bir asit ile tepkimeye girmez.
Aşağıdaki tepkime denklemlerini inceleyiniz.
***HCI asidi kuvvetlidir, ancak oksijen atomu içermez. Bu nedenle Cu, Hg ve Ag metalleri HCI çözeltisi ile tepkime vermez.
Cu(k) + HCl(suda) → Tepkime olmaz.
*** asidi oksijen atomu içerir, ancak zayıf bir asittir. Bu nedenle Cu, Hg ve Ag metalleri HCI çözeltisi ile tepkime vermez.
Cu(k) + (suda) → Tepkime olmaz.
*** asidi hem oksijen atomu içerir, hem de kuvvetli bir asittir. Bu nedenle Cu, Hg ve Ag metalleri
çözeltisi ile tepkime verir.
çözeltisi seyreltik ise oluşan gaz NO, derişik ise oluşan gaz
dir.
*** asidi hem oksijen atomu içerir, hem de kuvvetli bir asittir. Bu nedenle Cu, Hg ve Ag metalleri
ile tepkime verir. Ancak bu tepkimenin de bir istisnası vardır.
çözeltisi seyreltik ise tepkime olmaz, derişik ise tepkime gerçekleşir ve oluşan gaz
dir.
Tepkime olmaz.